
【题目】工业上利用CO和![]() 制
制![]() 的反应为
的反应为![]() 。实验测得在两种不同压强下,CO的平衡转化率
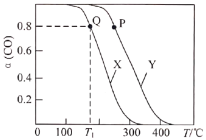
。实验测得在两种不同压强下,CO的平衡转化率![]() 与温度(T)的关系如图所示。查阅资料得:相同压强下,气体的分子数之比等于气体的体积之比。下列说法正确的是( )
与温度(T)的关系如图所示。查阅资料得:相同压强下,气体的分子数之比等于气体的体积之比。下列说法正确的是( )
A.反应![]() 的
的![]()
B.图中曲线X所对应的压强大于曲线Y所对应的压强
C.![]() ℃,
℃,![]() 时,平衡常数
时,平衡常数![]()
D.图中P点所示条件下,延长反应的时间能提高![]() 转化率
转化率
【答案】C
【解析】
A.由图象X或Y可知,随温度的升高,CO的转化率逐渐降低,说明平衡逆向移动,故正反应为放热反应,![]() ,故A错误;
,故A错误;
B.相同温度下,曲线X对应CO的转化率较Y低,若通过改变压强由曲线X至曲线Y,CO的转化率上升,即平衡向正向移动,该反应正向为气体体积减小的反应,因此由X至曲线Y为增大压强,故曲线X对应的压强小于曲线Y对应的压强,故B错误;
C.设起始容器体积为1L,T1℃下平衡时CO的转化率为80%,平衡时n(CO)=( 1-1×80%)mol=0.2mol,n(H2)=(2-1×80%×2)mol=0.4mol,n(CH3OH)=0.8mol,n总=(0.2+0.4+0.8)mol=1.4mol,此时容器的体积为:![]() =
=![]() L,c(CO)=
L,c(CO)=![]() mol/L,c(H2)=
mol/L,c(H2)=![]() mol/L,c(CH3OH)=
mol/L,c(CH3OH)=![]() mol/L,平衡常数
mol/L,平衡常数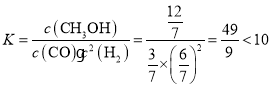 ,故C正确;
,故C正确;
D.P点反应已达到平衡状态,延长反应时间并不会改变平衡状态,不会提高CO转化率,故D错误;
故答案为:C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在2 L密闭容器中进行反应:mX(g)+nY(g)![]() pZ(g)+qQ(g),式中m、n、p、q为化学计量数。在0~3 min内,各物质物质的量的变化如下表所示:
pZ(g)+qQ(g),式中m、n、p、q为化学计量数。在0~3 min内,各物质物质的量的变化如下表所示:

已知2 min内v(Q)=0.075 mol·L-1·min-1,v(Z)∶v(Y)=1∶2。
(1)试确定:起始时n(Y)=________,n(Q)=________。
(2)方程式中m=________,n=________,p=________,q=________。
(3)用Z表示2 min内的反应速率________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的绝热密闭容器中发生反应:N2(g)+3H2(g)![]() 2NH3(g) △H<0。下列不能说明该反应达到化学平衡状态的是
2NH3(g) △H<0。下列不能说明该反应达到化学平衡状态的是
A.混合气体的密度不变B.体系温度不变
C.3v逆(NH3)=2v正(H2)D.N2和NH3的浓度的比值不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶洞的形成主要源于石灰岩受地下水的长期溶蚀,发生反应:CaCO3+CO2+H2O=Ca(HCO3)2。当受热或压强突然减小时溶解的Ca(HCO3)2会分解,从而形成钟乳石、石笋等奇妙景观。
(1)写出Ca(HCO3)2受热分解的离子方程式____;从平衡移动的角度解释压强减小时Ca(HCO3)2分解的原因_______。
(2)向Ca(HCO3)2饱和溶液中滴加酚酞,溶液呈很浅的红色。由此可得到的结论是:饱和溶液中Ca(HCO3)2水解程度__________且___________。
(3)常温下,H2CO3的电离常数Ka2=4.7×10-11。若测得5.0×10-3 mol/L Ca(HCO3)2溶液的pH为8.0,则溶液中c(CO32-)与c(OH-)的比值为___________(简要写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烟气中含有大量氮氧化物NOx,工业脱硝技术成为研究热点。
(1)汽车尾气中NO和CO可利用车载催化剂转化为无毒物质排放。
已知:N2(g)+O2(g)=2NO(g) △H1=+183 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H2=-565 kJ·mol-1
写出催化转化的热化学方程式_________。
(2)臭氧氧化-碱吸收法可有效脱除NO,氧化原理为:NO(g)+O3(g)![]() NO2(g)+O2(g) △H=-200.9 kJ·mol-1。在容积为2L的密闭容器中充入含1.0 mol NO的模拟烟气和2.0 mol O3,在不同温度,经过相同时间(10min)NO的转化率如图所示。
NO2(g)+O2(g) △H=-200.9 kJ·mol-1。在容积为2L的密闭容器中充入含1.0 mol NO的模拟烟气和2.0 mol O3,在不同温度,经过相同时间(10min)NO的转化率如图所示。
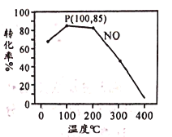
①100℃时,从开始反应到P点的平均反应速率v(NO)=__________。
②反应时同时发生副反应:2O3![]() 3O2,共有15%的O3自身分解为O2。则P点时O3的物质的量为________mol。
3O2,共有15%的O3自身分解为O2。则P点时O3的物质的量为________mol。
(3)选择性催化还原技术(NCR)可在较低温度下脱硝,原理如图I,天然锰矿可作催化剂。
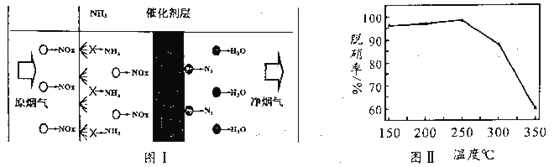
以NO代表氮氧化物,写出反应方程式_____________________;实验测得脱硝率随温度的变化如图II所示,请分析温度高于250℃时脱硝率下降的原因可能是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】呋喃酚是合成农药的重要中间体,其合成路线如下:
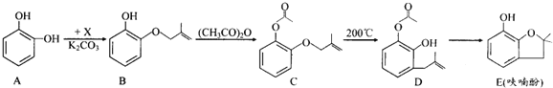
(1)A在空气中久置会由无色转变为棕褐色,其原因是____________,A在核磁共振氢谱中有___________组峰。
(2)B→C的反应类型是_____________________。
(3)已知X的分子式为C4H7Cl。写出A→B的化学方程式:___________________。
(4)要鉴别化合物C和D,适宜的试剂是__________________________。
(5)B的同分异构体很多,符合下列条件的有______种,写出其中能发生银镜反应的同分异构体的结构简式:__________(任写一种)。
①苯的衍生物 ②有两个互为对位的取代基 ③含有酯基
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设 NA 为阿伏加德罗常数的值。下列有关叙述正确的是
A.在 12.0g NaHSO4 晶体中,所含离子数目为 0.3NA
B.足量的镁与浓硫酸充分反应,放出 2.24L 混合气体时,转移电子数为 0.2NA
C.30g 冰醋酸和葡萄糖的混合物中含氢原子的数目为 2NA
D.标准状况下,11.2L 乙烯和丙烯混合物中含氢原子数目为 2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷、砷(As)、锑(Sb)、铋(Bi)、镆(Mc)为元素周期表中原子序数依次增大的同族元素。
(1)砷(As)在元素周期表中的位置为____________________,磷的基态原子的价电子排布式为__________,六种元素中电负性最大的是__________(填元素符号)。
(2)N2分子中σ键和π键的数目比N(σ): N(π)=__________。NH3的分子构型为__________,中心原子的杂化方式为__________。
(3)热稳定性:NH3_____PH3(填“>”或“<”),沸点:N2H4______P2H4(填“>”或“<”)。
(4)已知:P(s,白磷)=P(s,黑磷)ΔH=-39.3kJ·mol-1;P(s,白磷)=P(s,红磷)ΔH=-17.6kJ·mol-1
由此推知,其中最稳定的磷单质是__________。
(5)SbCl3能发生较强烈的水解,生成难溶的SbOCl,因此配制SbCl3溶液应加入__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知亚磷酸(H3PO3)是具有强还原性的弱酸,可以被银离子氧化为磷酸。1摩尔亚磷酸最多消耗2摩尔氢氧化钠。
(1)已知亚磷酸可由PCl3水解而成,请写出相应的离子方程式__________。
(2)Na2HPO3是____(填“正盐”或“酸式盐”) 。
(3)亚磷酸与银离子反应时氧化剂与还原剂的物质的量之比为______________。
(4)某温度下,0.10 molL-1的H3PO3溶液的pH为1.6,即c(H+)=2.5×10-2 molL-1,该温度下H3PO3的电离平衡常数K1=___________________;(结果保留两位有效数字)。
(5)向H3PO3溶液中滴加NaOH溶液至中性,所得溶液中:c(Na+)_____c(H2PO3-)+2c(HPO32-)(填“>”、“<”或“=”,下同);在NaH2PO3溶液中,c(H+)+c(H3PO3)_____c(HPO32-)+c(OH-)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com