
【题目】氮、磷、砷(As)、锑(Sb)、铋(Bi)、镆(Mc)为元素周期表中原子序数依次增大的同族元素。
(1)砷(As)在元素周期表中的位置为____________________,磷的基态原子的价电子排布式为__________,六种元素中电负性最大的是__________(填元素符号)。
(2)N2分子中σ键和π键的数目比N(σ): N(π)=__________。NH3的分子构型为__________,中心原子的杂化方式为__________。
(3)热稳定性:NH3_____PH3(填“>”或“<”),沸点:N2H4______P2H4(填“>”或“<”)。
(4)已知:P(s,白磷)=P(s,黑磷)ΔH=-39.3kJ·mol-1;P(s,白磷)=P(s,红磷)ΔH=-17.6kJ·mol-1
由此推知,其中最稳定的磷单质是__________。
(5)SbCl3能发生较强烈的水解,生成难溶的SbOCl,因此配制SbCl3溶液应加入__________。
【答案】第4周期第VA族 3s23p3 N 1:2 三角锥形 sp3 > > 黑磷 盐酸
【解析】
(1)As是33号元素;同主族元素原子序数越小电负性越强;
(2)氮气分子中为氮氮三键;根据价层电子对数和孤电子对数判断分子构型和杂化方式;
(3)元素的非金属性越强,其氢化物越稳定;分子晶体熔沸点与分子间作用力和氢键有关,能形成分子间氢键的氢化物熔沸点较高;
(4)能量越低越稳定;
(5)SbCl3能发生较强烈的水解,生成难溶的SbOCl,根据元素守恒知,还生成HCl。
(1)砷(As)在元素周期表中的位置为第4周期第VA族,价电子排布为3s23p3;同主族元素原子序数越小电负性越强,所以电负性最大的元素为N,故答案为:第4周期第VA族;3s23p3;N;
(2)一个氮氮三键中有一个σ键和两个π键,所以N(σ): N(π)=1:2;氨气分子中价层电子对数为![]() ,孤电子对数为1,故杂化方式为sp3,空间构型为三角锥形,故答案为:1:2;三角锥形;sp3;
,孤电子对数为1,故杂化方式为sp3,空间构型为三角锥形,故答案为:1:2;三角锥形;sp3;
(3)元素的非金属性越强,其氢化物越稳定;非金属性N>P,所以热稳定性:NH3>PH3;N2H4能形成分子间氢键、P2H4分子间不能形成氢键,所以沸点:N2H4>P2H4,故答案为:>;>;
(4)P(s,白磷)=P(s,黑磷)△H=-39.3 kJmol-1①
P(s,白磷)=P(s,红磷)△H=-17.6kJmol-1②
将方程式①-②得P(s,红磷)=P(s,黑磷)△H=(-39.3+17.6)kJ/mol=-21.7kJ/mol,
则能量:红磷>黑磷,则黑磷稳定,故答案为:黑磷;
(5)SbCl3能发生较强烈的水解,生成难溶的SbOCl,根据元素守恒知,还生成HCl,反应方程式为SbCl3+H2OSbOCl+2HCl,配制SbCl3溶液要防止其水解,其水溶液呈酸性,所以酸能抑制水解,则配制该溶液时为防止水解应该加入盐酸,故答案为:盐酸。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】实验室通常采用粗锌与稀硫酸制氢气,因此制氢废液中含有大量的硫酸锌,同时含少量硫酸亚铁、硫酸铅等杂质。由制氢废液制备硫酸锌晶体(ZnSO4·7H2O)的流程如下:

下列说法不正确的是
A. 步骤①,涉及的化学反应为:2Fe2++H2O2+2H+=2Fe3++2 H2O
B. 步骤②,加入适量ZnO的目的是:调节溶液pH,沉淀Fe3+
C. 步骤④,涉及的操作有:蒸发浓缩、冷却结晶、过滤、洗涤、干燥
D. 步骤⑤,产物一定是:ZnO和SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用CO和![]() 制
制![]() 的反应为
的反应为![]() 。实验测得在两种不同压强下,CO的平衡转化率
。实验测得在两种不同压强下,CO的平衡转化率![]() 与温度(T)的关系如图所示。查阅资料得:相同压强下,气体的分子数之比等于气体的体积之比。下列说法正确的是( )
与温度(T)的关系如图所示。查阅资料得:相同压强下,气体的分子数之比等于气体的体积之比。下列说法正确的是( )
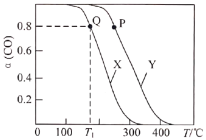
A.反应![]() 的
的![]()
B.图中曲线X所对应的压强大于曲线Y所对应的压强
C.![]() ℃,
℃,![]() 时,平衡常数
时,平衡常数![]()
D.图中P点所示条件下,延长反应的时间能提高![]() 转化率
转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】判断下列各反应是否为氧化还原反应,是氧化还原反应的,标出电子转移方向和数目,指出氧化剂、还原剂、氧化产物、还原产物。
(1)2Fe+3Cl2![]() 2FeCl3_______
2FeCl3_______
(2)![]() _______
_______
(3)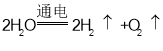 _______
_______
(4)2H2S+SO2=3S↓+2H2O_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H的分子中含有醛基和酯基。H可以用C和F在一定条件下合成(如图):
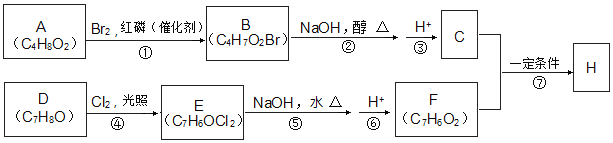
已知以下信息:
①A的核磁共振氢谱中有三组峰;且能与饱和碳酸氢钠溶液反应放出CO2。
②RCH2COOH 。
。
③化合物D苯环上的一氯代物只有两种。
④通常同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
(1)A的名称为___。
(2)D的官能团名称为___。
(3)反应②的化学方程式为__,⑦的反应类型为___。
(4)F的结构简式为__。
(5)H在一定条件下反应生成高聚物的化学方程式为___。
(6)F的同系物G比F相对分子质量大14,G的同分异构体中能同时满足如下条件:
①苯环上只有两个取代基;②不能使FeCl3溶液显色,共有__种(不考虑立体异构)。其中能与碳酸氢钠溶液反应且核磁共振氢谱为4组峰,且峰面积比为3:2:2:1,写出G的这种同分异构体的结构简式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向NaHCO3溶液中滴入盐酸,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是( )
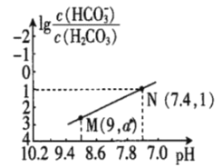
A.25℃时,H2CO3的一级电离K(H2CO3)=1.0×10-6.4
B.图中a=2.6
C.25℃时,HCO3-+H2O![]() H2CO3+OH-的Kh=1.0×10-7.6
H2CO3+OH-的Kh=1.0×10-7.6
D.M点溶液中:c(H+)+c(H2CO3)=c(Cl-)+2c(CO32-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是
A.1 mol K2Cr2O7被还原为Cr3+转移的电子数为3NA
B.合成氨反应中,1 mol N2与4 mol H2反应生成的NH3分子数为2NA
C.1 L 0.1 mol·L-1磷酸钠溶液含有离子的数目为0.1NA
D.常温常压下,18.4 g NO2和N2O4的混合气体中含有的氮原子总数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.萘(![]() )是最简单的稠环芳香烃,萘与足量氢气充分加成的产物一氯代物有2种
)是最简单的稠环芳香烃,萘与足量氢气充分加成的产物一氯代物有2种
B.酚酞的结构如图所示,其结构中含有羟基(—OH),故酚酞属于醇
![]()
C.溴水能将 甲苯、己烯、CCl4、乙醇四种溶液鉴别开来
D. ![]() 的名称为2-甲基-戊醇
的名称为2-甲基-戊醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加碘食盐中含碘酸钾(KIO3),化学兴趣小组对加碘食盐展开研究性学习。
(1)加碘食盐中KIO3的制备可以采用以下两种方法:
方法一:碘单质与KClO3溶液反应生成KIO3和Cl2;
方法二:碘单质与H2O2在催化剂作用下反应生成HIO3,再与K2CO3作用生成KIO3;两种方法制等质量的KIO3,理论上消耗KClO3和H2O2的物质的量之比为 _______ 。
(2)兴趣小组测定食用精制盐中碘元素含量的实验步骤为:
步骤1:准确称取25.00 g食盐,加适量蒸馏水使其完全溶解,配成100.00 mL溶液;
步骤2:取所配溶液25.00 mL于锥形瓶中,用稀硫酸酸化该溶液,加入足量KI溶液,使之充分反应;
步骤3:滴入2~3滴淀粉溶液作指示剂,用1.0×10-3 mol·L-1的Na2S2O3标准溶液滴定至终点,恰好完全反应时消耗12.00 mL标准溶液。
已知步骤3中所发生反应的离子方程式为I2+2S2O32-=2I-+S4O62-。
①步骤3中滴定终点的现象是 _______ 。
②下列情况会使测定结果偏大的是 _______ 。
A 装Na2S2O3标准溶液的滴定管水洗后未用Na2S2O3标准溶液润洗
B 装Na2S2O3标准溶液的滴定管滴定前有气泡,滴定终了无气泡
C 滴定时未充分振荡,溶液局部变色就终止
D 若其他读数正确,滴定结束读数时俯视
③计算该精制盐的碘元素含量(mg·kg-1),写出计算过程_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com