
【题目】25℃时,向NaHCO3溶液中滴入盐酸,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是( )
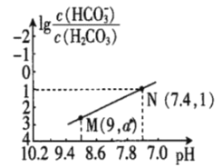
A.25℃时,H2CO3的一级电离K(H2CO3)=1.0×10-6.4
B.图中a=2.6
C.25℃时,HCO3-+H2O![]() H2CO3+OH-的Kh=1.0×10-7.6
H2CO3+OH-的Kh=1.0×10-7.6
D.M点溶液中:c(H+)+c(H2CO3)=c(Cl-)+2c(CO32-)+c(OH-)
【答案】D
【解析】
A.25℃时,在N点,pH=7.4,则c(H+)=10-7.4,lg![]() =1,则
=1,则![]() =10, H2CO3的一级电离K(H2CO3)=
=10, H2CO3的一级电离K(H2CO3)=![]() =10-7.4×10=1.0×10-6.4,A正确;
=10-7.4×10=1.0×10-6.4,A正确;
B.图中M点,pH=9,c(H+)=10-9,K(H2CO3)=![]() =1.0×10-6.4,
=1.0×10-6.4,![]() =102.6,a= lg
=102.6,a= lg![]() =2.6,B正确;
=2.6,B正确;
C.25℃时,HCO3-+H2O![]() H2CO3+OH-的Kh=
H2CO3+OH-的Kh= ![]() =
=![]() =1.0×10-7.6,C正确;
=1.0×10-7.6,C正确;
D.M点溶液中:依据电荷守恒,c(H+)+c(Na+)=c(Cl-)+2c(CO32-)+c(OH-)+ c(HCO3-),此时溶液为NaHCO3、NaCl的混合溶液,则c(Na+)>c(H2CO3) + c(HCO3-),所以c(H+)+c(H2CO3)<c(Cl-)+2c(CO32-)+c(OH-),D错误;
故选D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已烯雌酚是人工合成的非甾体雌激素物质,主要用于治疗雌激素低下症及激素平衡失调所引起的功能性出血等,如图所示分别取l mol已烯雌酚进行4个实验。
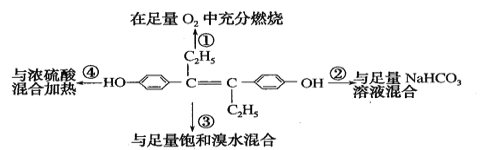
下列对实验数据的预测与实际情况吻合的是( )
A. ④中发生消去反应B. ①中生成7molH2O
C. ②中无CO2生成D. ③中最多消耗3molBr2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种短周期元素在元素周期表中的相对位置如图所示。下列说法正确的是
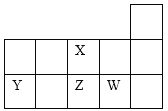
A.Y、Z、X三种元素的原子半径依次增大
B.X、Z都是第二周期ⅥA族元素,单质的氧化性X>Z
C.Y的气态氢化物的热稳定性比Z的高
D.W元素最高价氧化物的水化物的酸性比Z的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是
A.标准状况下,22.4 L Cl2与水充分反应,转移电子数为NA
B.31 g P4(分子结构:![]() )中的共价键数目为1.5NA
)中的共价键数目为1.5NA
C.30 g甲醛、乙酸的混合物完全燃烧,产生的CO2分子数目为NA
D.1 L 0.5 mol·L-1的Na2CO3溶液中含有的阴离子总数大于0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量Na2CO3、NaHCO3组成的混合物溶于水配成50 mL溶液,逐滴加入稀盐酸,得到各成分物质的量变化如图所示(忽略溶液混合导致的体积变化,已知1 mol=1000 mmol)。
下列说法不正确的是
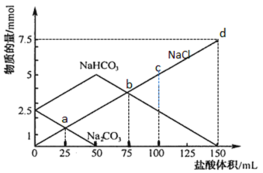
A.盐酸的物质的量浓度为0.05 mol·L-1
B.c点溶液中c(NaCl)=0.05 mol·L-1
C.a点溶液中发生反应的离子方程式为:CO![]() + H+ = HCO
+ H+ = HCO![]()
D.b点和d点所处的溶液中n(Na+)相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲硅烷广泛用于电子工业、汽车领域,三氯氢硅(![]() )是制备甲硅烷的重要原料。回答下列问题:
)是制备甲硅烷的重要原料。回答下列问题:
(1)工业上以硅粉和氯化氢气体为原料生产![]() 时伴随发生的反应有:
时伴随发生的反应有:
①![]()
②![]()
以硅粉和氯化氢气体生产![]() 的热化学方程式是_______________________。
的热化学方程式是_______________________。
(2)工业上可用四氯化硅和氢化铝锂(![]() )制甲硅烷,反应后得甲硅烷及两种盐。该反应的化学方程式为_________________________________________________。
)制甲硅烷,反应后得甲硅烷及两种盐。该反应的化学方程式为_________________________________________________。
(3)三氯氢硅歧化也可制得甲硅烷。反应![]() 为歧化制甲硅烷过程的关键步骤,此反应采用一定量的
为歧化制甲硅烷过程的关键步骤,此反应采用一定量的![]() 催化剂,在不同反应温度下测得
催化剂,在不同反应温度下测得![]() 的转化率随时间的变化关系如图所示。
的转化率随时间的变化关系如图所示。
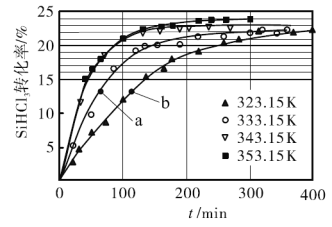
①![]() 时,平衡转化率为_________。该反应是__________反应(填“放热”或“吸热”)。
时,平衡转化率为_________。该反应是__________反应(填“放热”或“吸热”)。
②![]() 时,要缩短反应达到平衡的时间,可采取的措施有________________________。(答一种即可)
时,要缩短反应达到平衡的时间,可采取的措施有________________________。(答一种即可)
③比较a、b处反应速率的大小:![]() _______________
_______________![]() (填“>”“<”或“=”)。已知反应速率
(填“>”“<”或“=”)。已知反应速率![]() 分别是正、逆反应的速率常数,与反应温度有关,x为物质的量分数,则在
分别是正、逆反应的速率常数,与反应温度有关,x为物质的量分数,则在![]() 时
时![]() ___________(保留3位小数)。
___________(保留3位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C物质为烃类,在标准状况下的密度为1.16g/L,F物质具有水果香味,G物质不能水解。转化关系如图所示,省略了反应条件。
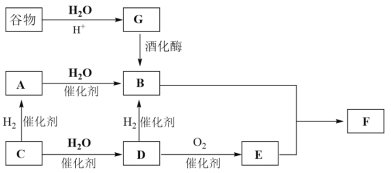
请回答下列问题:
(1)写出G的分子式:____________________。
(2)D中官能团的名称是__________________________。 C→A的反应类型____________
(3)请写出反应B+E→F的化学方程式:______________________。
(4)下列有关说法正确的是_____________________________。
A.C物质燃烧时,易产生大量黑烟 B.物质B和甘油(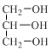 )互为同系物
)互为同系物
C.一定条件下,A可被直接氧化为D D.用NaOH溶液可以区分B、D、F
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有原子序数依次增大的A、B、C、D、E五种前四周期元素,B元素原子有三个能级,且每个能级上的电子数相等;C原子的p轨道处于半充满状态,D的单质是空气的主要成分之一,其质子数为A与C之和;E在周期表中位于ds区,且与D可形成化学式为E2D或ED的二元化合物。请回答下列问题:
(1)E元素基态原子的M能层中具有_____个能级,该元素的常见化合价有多种,其中E+的简化电子排布式为__________。
A.[Ar]3d104s1 B.[Ar]3d10 C.[Ar]3d94s1 D.[Ar]3d84s2
(2)元素C和D的原子的第一电离能较大的为__________(填元素符号),其原因是____________________;C与A可形成一种常见的气态化合物,该化合物的空间构型为____________________,其中C原子的杂化轨道类型为____________________。
(3)C2在日常生活及工农业生产等领域用途非常广泛,其分子结构中σ键和π键数目之比是_______;C2D与BD2互为__________(填“等电子体”或“非等电子体”),其理由是____________________。
(4)在E催化下,分子式为BA4D的化合物可被氧化为分子式为BA2D的化合物,则BA2D分子中键角约为__________;BA4D和BA2D两化合物均易溶于水,是由于与水分子间形成了__________键的缘故。
(5)元素E的单质晶体在不同温度下可有两种堆积方式,晶胞分别如图a和b所示,则其面心立方堆积的晶胞与体心立方堆积的晶胞中实际含有的E原子的个数之比为__________;元素B的单质晶体结构有多种,其中一种硬度很大,结构如下图,则该单质晶体的熔点_______E单质晶体的熔点(填“高于”或“低于”);若B单质的原子(如图中A、B两原子)在体对角线上外切,晶胞参数为a,则该晶体的空间利用率约为__________。(百分数表示,取两位有效数字)(已知![]() =1.732)
=1.732)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平。请回答:
(1)乙烯的结构简式为__________。
(2)下列可以鉴别甲烷和乙烯的试剂为__________(填选项字母)。
A.稀硫酸 B.溴的四氯化碳溶液 C.水 D.酸性高锰酸钾溶液
(3)下列物质中,不能通过乙烯加成反应得到的是__________(填选项字母)。
A.CH3CH3 B.CH3CHCl2 C.CH3CH2OH D.CH3CH2Br
(4)以乙烯为主要原料合成乙酸,B能发生银镜反应。合成线路如图所示:
![]()
反应①的化学方程式为__________。反应③的反应类型为__________反应(填有机反应基本反应类型)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com