
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是
A.标准状况下,22.4 L Cl2与水充分反应,转移电子数为NA
B.31 g P4(分子结构:![]() )中的共价键数目为1.5NA
)中的共价键数目为1.5NA
C.30 g甲醛、乙酸的混合物完全燃烧,产生的CO2分子数目为NA
D.1 L 0.5 mol·L-1的Na2CO3溶液中含有的阴离子总数大于0.5NA
【答案】A
【解析】
A.标准状况下22.4L氯气为1mol,氯气与水反应生成氯化氢和次氯酸,但该反应为可逆反应,1mol氯气不能完全消耗,故转移电子数小于NA,A错误;
B.1mol P4中含有6mol P-P共价键,31g P4物质的量为0.25mol,则0.25mol P4中共有1.5mol共价键,即1.5NA个,B正确;
C.甲醛和乙酸的最简式均为CH2O,30g混合物中有1mol “CH2O”,则1mol混合物完全燃烧生成CO2的分子数为NA,C正确;
D.1 L 0.5 mol·L-1的Na2CO3溶液中,由于碳酸根发生水解反应生成氢氧根,故溶液中阴离子总数大于0.5NA,D正确;
故选A。


科目:高中化学 来源: 题型:
【题目】汽车尾气系统中的催化转化器,可有效降低尾气中的CO、NO和NO2等向大气的排放。在催化转化器的前半部发生的反应为2CO(g)+2NO(g)![]() 2CO2(g)+N2(g)。一定条件下,下列说法能充分说明该反应已经达到化学平衡状态的是
2CO2(g)+N2(g)。一定条件下,下列说法能充分说明该反应已经达到化学平衡状态的是
A. 正、逆反应速率都等于零B. CO、NO、CO2、N2的浓度相等
C. CO、NO、CO2、N2在容器中共存D. CO、NO、CO2、N2的浓度均不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】安徽省具有丰富的铜矿资源,请回答下列有关铜及其化合物的问题,
(1)请写出基态Cu原子的外围电子排布式 ____________ 。焰火中的绿色是铜的焰色,基态铜原子在灼烧时外围电子发生了 _________ 而变为激发态。
(2)新型农药松脂酸铜具有低残留的特点,下图是松脂酸铜的结构简式

请分析1个松脂酸铜中π键的个数_____ ;加 “*”碳原子的杂化方式为 ______ 。
(3)下图是某铜矿的晶胞图,请推算出此晶胞的化学式(以X表示某元素符号)______________ ;与X等距离且最近的X原子个数为____

(4)黄铜矿在冶炼的时候会产生副产品SO2,SO2分子的几何构型______,比较第一电离能:S _____ O(填“>”或“<”)
(5)黄铜合金可以表示为Cu3Zn,为面心立方晶胞,晶体密度为8.5g/cm3,求晶胞的边长(只写计算式,不求结果)____________ nm。

查看答案和解析>>
科目:高中化学 来源: 题型:
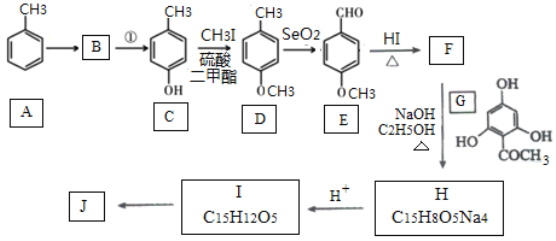
【题目】根皮素J (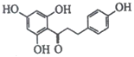 )是一种新型天然美白剂,主要分布于苹果、梨等多汁水果的果皮及根皮.其中一种合成J的路线如下:
)是一种新型天然美白剂,主要分布于苹果、梨等多汁水果的果皮及根皮.其中一种合成J的路线如下:
已知:
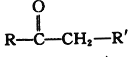 +R"CHO
+R"CHO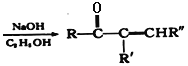 +H2O
+H2O
回答下列问题:
(1)C的化学名称是___________.E中官能团的名称为_______________.
(2)B为溴代烃,请写出A→B的反应试剂___________.
(3)写出由C生成D的反应类型___________
(4)F→H的化学方程式为______________________.
(5)M是E的同分异构体,同时符合下列条件的M的结构有___________种(不考虑立体异构)
①能与FeCl3溶液发生显色反应
②能发生银镜反应
(6)设计以丙烯和1,3-丙二醛为起始原料制备![]() 的合成路线_______(无机试剂任选).
的合成路线_______(无机试剂任选).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是()
A.Ca(HCO3)2溶液与少量NaOH溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
B.用铜作电极电解食盐水:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
C.向氧化铁中加入氢碘酸:Fe2O3+6H+=2Fe3++3H2O
D.向一定量明矾溶液中滴加Ba(OH)2溶液至生成沉淀的物质的量最多:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚苯胺是一种在充放电过程中具有更优异可逆性的电极材料。Zn一聚苯胺二次电池的结构示意图如图所示,设NA为阿伏加德罗常数的值。下列说法错误的是( )
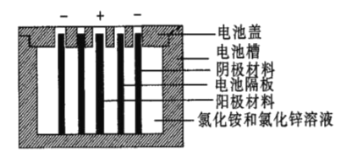
A.放电时,外电路每通过0.1NA个电子时,锌片的质量减少3.25g
B.充电时,聚苯胺电极的电势低于锌片的电势
C.放电时,混合液中的Cl-向负极移动
D.充电时,聚苯胺电极接电源的正极,发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向NaHCO3溶液中滴入盐酸,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是( )
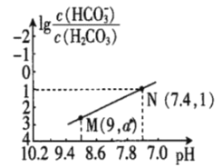
A.25℃时,H2CO3的一级电离K(H2CO3)=1.0×10-6.4
B.图中a=2.6
C.25℃时,HCO3-+H2O![]() H2CO3+OH-的Kh=1.0×10-7.6
H2CO3+OH-的Kh=1.0×10-7.6
D.M点溶液中:c(H+)+c(H2CO3)=c(Cl-)+2c(CO32-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2C2O4是一种二元弱酸。常温下向H2C2O4溶液中滴加KOH溶液,混合溶液中离子浓度与pH的关系如图所示,其中![]() 或
或![]() 。下列说法正确的是
。下列说法正确的是
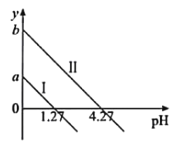
A.直线I表示的是![]() 与pH的变化关系
与pH的变化关系
B.图中纵坐标应该是a=1.27,b=4.27
C.c(![]() )>c(
)>c(![]() )>c(H2C2O4)对应1.27<pH<4.27
)>c(H2C2O4)对应1.27<pH<4.27
D.c(K+)=c(![]() )+c(
)+c(![]() )对应pH=7
)对应pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸盐与钴(Ⅲ)形成的一种配合物1Co(NH3)5NO2]Cl2的制备流程如下:
![]()
(1)Co2+基态核外电子排布式为 。
(2)配合物1Co(NH3)5Cl]Cl2中与Co3+形成配位键的原子为 (填元素符号);配离子 1Co(NH3)5NO2]2+的配体中氮原子的杂化轨道类型为 。
(3)与NO2-互为等电子体的单质分子为 (写化学式)。
(4)H2O2与H2O可以任意比例互溶,除因为它们都是极性分子外,还因为 。
(5)亚硝酸盐在水体中可转化为强致癌物亚硝胺,亚硝胺NDMA的结构简式如图所示,1molNDMA分子中含有![]() 键的数目为 mol。
键的数目为 mol。
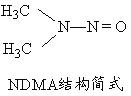
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com