
【题目】H2C2O4是一种二元弱酸。常温下向H2C2O4溶液中滴加KOH溶液,混合溶液中离子浓度与pH的关系如图所示,其中![]() 或
或![]() 。下列说法正确的是
。下列说法正确的是
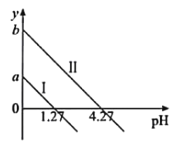
A.直线I表示的是![]() 与pH的变化关系
与pH的变化关系
B.图中纵坐标应该是a=1.27,b=4.27
C.c(![]() )>c(
)>c(![]() )>c(H2C2O4)对应1.27<pH<4.27
)>c(H2C2O4)对应1.27<pH<4.27
D.c(K+)=c(![]() )+c(
)+c(![]() )对应pH=7
)对应pH=7
【答案】B
【解析】
A. 二元弱酸草酸的![]() ,
,![]() ,当lgy=0时,pH=lgc(H+)=lgK,pH1=1.27<pH2=4.27,表明K1=101.27>K2=104.27,所以直线I表示的是
,当lgy=0时,pH=lgc(H+)=lgK,pH1=1.27<pH2=4.27,表明K1=101.27>K2=104.27,所以直线I表示的是![]() 与pH的变化关系,直线Ⅱ表示的是
与pH的变化关系,直线Ⅱ表示的是![]() 与pH的变化关系,故A错误;
与pH的变化关系,故A错误;
B. pH=0时,![]() ,
,![]() ,则图中纵坐标应该是a=1.27,b=4.27,故B正确;
,则图中纵坐标应该是a=1.27,b=4.27,故B正确;
C. 设pH=a,c(H+)=10a,![]() ,c(
,c(![]() )>c(
)>c(![]() ),104.27-a>1,则4.27-a>0,解得a<4.27,
),104.27-a>1,则4.27-a>0,解得a<4.27,![]() ,
,![]() ,当c(
,当c(![]() )>c(H2C2O4),102a-5.54>1,则2a-5.54>0,解得a>2.77,所以c(
)>c(H2C2O4),102a-5.54>1,则2a-5.54>0,解得a>2.77,所以c(![]() )>c(
)>c(![]() )>c(H2C2O4)对应2.77<pH<4.27,故C正确;
)>c(H2C2O4)对应2.77<pH<4.27,故C正确;
D. 电荷守恒:c(K+)+c(H+)=c(![]() )+2c(
)+2c(![]() )+c(OH-),当c(K+)=c(
)+c(OH-),当c(K+)=c(![]() )+2c(
)+2c(![]() )时,c(H+)=c(OH-),对应pH=7,故D错误;
)时,c(H+)=c(OH-),对应pH=7,故D错误;
故选B。


 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:
【题目】已知有机化合物A、B、C、D、E存在下图所示转化关系,且C能跟NaHCO3发生反应,C和D的相对分子质量相等,E为无支链的化合物。
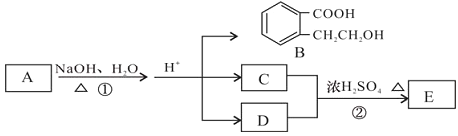
请回答下列问题:
(1)已知E的相对分子质量为102,其中碳、氢两种元素的质量分数分别为58.8%、9.8%,其余为氧,则E的分子式为_________________。
(2)B在一定条件下可以发生缩聚反应生成某高分子化合物,此高分子化合物的结构简式为_________________。
(3)D也可以由溴代烃F在NaOH溶液中加热来制取,写出此反应的化学方程式_________________。
(4)反应①的化学方程式_________________。
(5)B有多种同分异构体,请写出一种同时符合下列四个条件的结构简式:_________________。
a.能够发生水解
b.能发生银镜反应
c.能够与FeCl3溶液显紫色
d.苯环上的一氯代物只有一种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是
A.标准状况下,22.4 L Cl2与水充分反应,转移电子数为NA
B.31 g P4(分子结构:![]() )中的共价键数目为1.5NA
)中的共价键数目为1.5NA
C.30 g甲醛、乙酸的混合物完全燃烧,产生的CO2分子数目为NA
D.1 L 0.5 mol·L-1的Na2CO3溶液中含有的阴离子总数大于0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲硅烷广泛用于电子工业、汽车领域,三氯氢硅(![]() )是制备甲硅烷的重要原料。回答下列问题:
)是制备甲硅烷的重要原料。回答下列问题:
(1)工业上以硅粉和氯化氢气体为原料生产![]() 时伴随发生的反应有:
时伴随发生的反应有:
①![]()
②![]()
以硅粉和氯化氢气体生产![]() 的热化学方程式是_______________________。
的热化学方程式是_______________________。
(2)工业上可用四氯化硅和氢化铝锂(![]() )制甲硅烷,反应后得甲硅烷及两种盐。该反应的化学方程式为_________________________________________________。
)制甲硅烷,反应后得甲硅烷及两种盐。该反应的化学方程式为_________________________________________________。
(3)三氯氢硅歧化也可制得甲硅烷。反应![]() 为歧化制甲硅烷过程的关键步骤,此反应采用一定量的
为歧化制甲硅烷过程的关键步骤,此反应采用一定量的![]() 催化剂,在不同反应温度下测得
催化剂,在不同反应温度下测得![]() 的转化率随时间的变化关系如图所示。
的转化率随时间的变化关系如图所示。
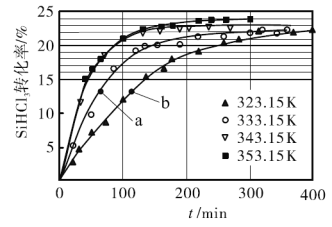
①![]() 时,平衡转化率为_________。该反应是__________反应(填“放热”或“吸热”)。
时,平衡转化率为_________。该反应是__________反应(填“放热”或“吸热”)。
②![]() 时,要缩短反应达到平衡的时间,可采取的措施有________________________。(答一种即可)
时,要缩短反应达到平衡的时间,可采取的措施有________________________。(答一种即可)
③比较a、b处反应速率的大小:![]() _______________
_______________![]() (填“>”“<”或“=”)。已知反应速率
(填“>”“<”或“=”)。已知反应速率![]() 分别是正、逆反应的速率常数,与反应温度有关,x为物质的量分数,则在
分别是正、逆反应的速率常数,与反应温度有关,x为物质的量分数,则在![]() 时
时![]() ___________(保留3位小数)。
___________(保留3位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】C物质为烃类,在标准状况下的密度为1.16g/L,F物质具有水果香味,G物质不能水解。转化关系如图所示,省略了反应条件。
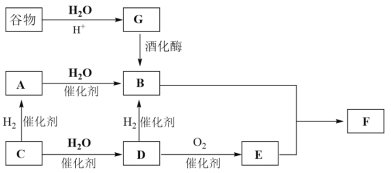
请回答下列问题:
(1)写出G的分子式:____________________。
(2)D中官能团的名称是__________________________。 C→A的反应类型____________
(3)请写出反应B+E→F的化学方程式:______________________。
(4)下列有关说法正确的是_____________________________。
A.C物质燃烧时,易产生大量黑烟 B.物质B和甘油(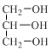 )互为同系物
)互为同系物
C.一定条件下,A可被直接氧化为D D.用NaOH溶液可以区分B、D、F
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有原子序数依次增大的A、B、C、D、E五种前四周期元素,B元素原子有三个能级,且每个能级上的电子数相等;C原子的p轨道处于半充满状态,D的单质是空气的主要成分之一,其质子数为A与C之和;E在周期表中位于ds区,且与D可形成化学式为E2D或ED的二元化合物。请回答下列问题:
(1)E元素基态原子的M能层中具有_____个能级,该元素的常见化合价有多种,其中E+的简化电子排布式为__________。
A.[Ar]3d104s1 B.[Ar]3d10 C.[Ar]3d94s1 D.[Ar]3d84s2
(2)元素C和D的原子的第一电离能较大的为__________(填元素符号),其原因是____________________;C与A可形成一种常见的气态化合物,该化合物的空间构型为____________________,其中C原子的杂化轨道类型为____________________。
(3)C2在日常生活及工农业生产等领域用途非常广泛,其分子结构中σ键和π键数目之比是_______;C2D与BD2互为__________(填“等电子体”或“非等电子体”),其理由是____________________。
(4)在E催化下,分子式为BA4D的化合物可被氧化为分子式为BA2D的化合物,则BA2D分子中键角约为__________;BA4D和BA2D两化合物均易溶于水,是由于与水分子间形成了__________键的缘故。
(5)元素E的单质晶体在不同温度下可有两种堆积方式,晶胞分别如图a和b所示,则其面心立方堆积的晶胞与体心立方堆积的晶胞中实际含有的E原子的个数之比为__________;元素B的单质晶体结构有多种,其中一种硬度很大,结构如下图,则该单质晶体的熔点_______E单质晶体的熔点(填“高于”或“低于”);若B单质的原子(如图中A、B两原子)在体对角线上外切,晶胞参数为a,则该晶体的空间利用率约为__________。(百分数表示,取两位有效数字)(已知![]() =1.732)
=1.732)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1mol/LNaOH溶液分别滴定体积均为20.00mL、浓度均为0.1mol/L的HX、HY溶液,pH随NaOH溶液体积变化如图。下列结论正确的是( )
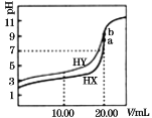
A.已知室温下某碱AOH的Kb=1×10-9,则AY的水溶液呈碱性
B.当加入10.00mL NaOH溶液时,有c(Na+)>c(HX)> c(X-)> c(H+)
C.pH=7时,c(Y-)=c(X-)
D.a、b两点溶液混合后,c(HX)+c(HY)+c(H+)=c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com