
【题目】常温下,用0.1mol/LNaOH溶液分别滴定体积均为20.00mL、浓度均为0.1mol/L的HX、HY溶液,pH随NaOH溶液体积变化如图。下列结论正确的是( )
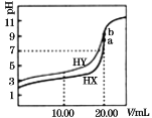
A.已知室温下某碱AOH的Kb=1×10-9,则AY的水溶液呈碱性
B.当加入10.00mL NaOH溶液时,有c(Na+)>c(HX)> c(X-)> c(H+)
C.pH=7时,c(Y-)=c(X-)
D.a、b两点溶液混合后,c(HX)+c(HY)+c(H+)=c(OH-)
【答案】D
【解析】
A.室温下HY的Ka=![]() =1×10-5,某碱AOH的Kb = 1×10-9,则Ka> Kb ,AY的水溶液呈酸性,A错误;
=1×10-5,某碱AOH的Kb = 1×10-9,则Ka> Kb ,AY的水溶液呈酸性,A错误;
B.当加入10.00 mL NaOH溶液时,溶液为等浓度的HX、NaX溶液,溶液的pH<5,则以HX的电离为主,从而得出c(X-)>c(Na+)> c(HX)> c(H+),B错误;
C.从图中可能看出,pH=7时,HY消耗NaOH的物质的量少,则c(Y-)<c(X-),C错误;
D.a、b两点,酸与碱刚好完全反应,溶质分别为NaX和NaY,溶液中存在以下水解和电离:X-+H2O![]() HX+OH-、Y-+H2O
HX+OH-、Y-+H2O![]() HY+OH-、H2O
HY+OH-、H2O![]() H++OH-,所以混合后,c(HX)+ c(HY)+ c(H+)= c(OH-),D正确;
H++OH-,所以混合后,c(HX)+ c(HY)+ c(H+)= c(OH-),D正确;
故选D。


科目:高中化学 来源: 题型:
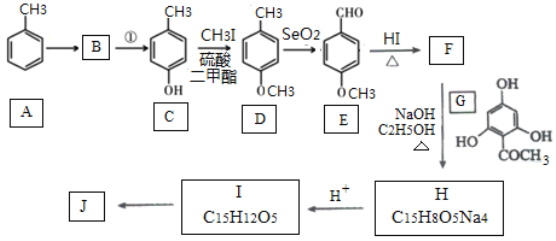
【题目】根皮素J (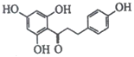 )是一种新型天然美白剂,主要分布于苹果、梨等多汁水果的果皮及根皮.其中一种合成J的路线如下:
)是一种新型天然美白剂,主要分布于苹果、梨等多汁水果的果皮及根皮.其中一种合成J的路线如下:
已知:
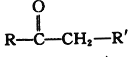 +R"CHO
+R"CHO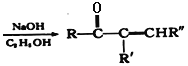 +H2O
+H2O
回答下列问题:
(1)C的化学名称是___________.E中官能团的名称为_______________.
(2)B为溴代烃,请写出A→B的反应试剂___________.
(3)写出由C生成D的反应类型___________
(4)F→H的化学方程式为______________________.
(5)M是E的同分异构体,同时符合下列条件的M的结构有___________种(不考虑立体异构)
①能与FeCl3溶液发生显色反应
②能发生银镜反应
(6)设计以丙烯和1,3-丙二醛为起始原料制备![]() 的合成路线_______(无机试剂任选).
的合成路线_______(无机试剂任选).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2C2O4是一种二元弱酸。常温下向H2C2O4溶液中滴加KOH溶液,混合溶液中离子浓度与pH的关系如图所示,其中![]() 或
或![]() 。下列说法正确的是
。下列说法正确的是
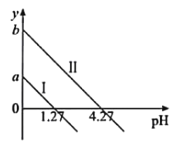
A.直线I表示的是![]() 与pH的变化关系
与pH的变化关系
B.图中纵坐标应该是a=1.27,b=4.27
C.c(![]() )>c(
)>c(![]() )>c(H2C2O4)对应1.27<pH<4.27
)>c(H2C2O4)对应1.27<pH<4.27
D.c(K+)=c(![]() )+c(
)+c(![]() )对应pH=7
)对应pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酰紫草素具有抗菌、抗炎、抗病毒、抗肿瘤等作用,它的结构简式如图所示,下列有关乙酰紫草素的说法正确的是

A. 该分子中含有1个手性碳原子
B. 1mol乙酰紫草素最多可与2mol NaOH反应
C. 1mol 乙酰紫草素最多可与2mol Br2反应
D. 能与FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】形形色色的物质,构成了我们这个五彩缤纷的世界。世上万物,神奇莫测,常常超乎人们按“常理"的想象。学习物质结构和性质的知识,能使你想象的翅膀变得更加有力。
(1)基态Ga原子的核外电子排布式是[Ar]_____________,基态Ga原子核外电子占据最高能级的电子云轮廓图为___________。
(2)硒的含氧酸有H2SeO3,H2SeO4。酸性:H2SeO3____________H2SeO4(填“>”“<”或“=”)。SeO32的空间构型是_____________________。
(3)NaN3是汽车安全气囊中的主要化学成分,其阴离子的立体构型为_____________。写出和该阴离子互为等电子体的一种分子的结构式_______________。
(4)钙和铁都是第四周期元素,且原子的最外层电子数相同,铁的熔沸点远高于钙,其原因是_____。
(5)配体中配位原子提供孤电子对的能力与元素的电负性有关,SCN-的结构式可以表示为[S=C=N]-或[S-C≡N]-,SCN-与Fe3+、Au+和Hg2+等离子能形成配离子,N、C、S的电负性依次为3.0、2.5和2.5。SCN-中提供孤电子对的原子可能是_______。
(6)某离子晶体XY2的晶胞结构如图所示。

①晶体中在每个X周围与它最近且距离相等的X共有_________个。
②设该晶体的摩尔质量为Mg·mol-1,晶胞的密度为ρg.cm-3,阿伏加德罗常数为NA,则晶体中两个最近的X间的距离为________cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸盐与钴(Ⅲ)形成的一种配合物1Co(NH3)5NO2]Cl2的制备流程如下:
![]()
(1)Co2+基态核外电子排布式为 。
(2)配合物1Co(NH3)5Cl]Cl2中与Co3+形成配位键的原子为 (填元素符号);配离子 1Co(NH3)5NO2]2+的配体中氮原子的杂化轨道类型为 。
(3)与NO2-互为等电子体的单质分子为 (写化学式)。
(4)H2O2与H2O可以任意比例互溶,除因为它们都是极性分子外,还因为 。
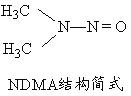
(5)亚硝酸盐在水体中可转化为强致癌物亚硝胺,亚硝胺NDMA的结构简式如图所示,1molNDMA分子中含有![]() 键的数目为 mol。
键的数目为 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒是人体必需的微量元素,右图是硒在周期表中的信息,关于硒元素的说法错误的是

A. 位于第四周期
B. 质量数为34
C. 原子最外层有6个电子
D. 相对原子质量为78.96
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意完成下列填空。
(1)a.金刚石和石墨 b.12C和13C c.CH4和C2H6 d.乙醇与二甲醚(填字母)
①互为同位素的是___;
②互为同素异形体的是___;
③互为同系物的是___;
④互为同分异构体的是___。
(2)请补充完下列方程式:
①CH4+Cl2![]() ___+HCl
___+HCl
②CH2=CH2+Br2→___
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com