
【题目】形形色色的物质,构成了我们这个五彩缤纷的世界。世上万物,神奇莫测,常常超乎人们按“常理"的想象。学习物质结构和性质的知识,能使你想象的翅膀变得更加有力。
(1)基态Ga原子的核外电子排布式是[Ar]_____________,基态Ga原子核外电子占据最高能级的电子云轮廓图为___________。
(2)硒的含氧酸有H2SeO3,H2SeO4。酸性:H2SeO3____________H2SeO4(填“>”“<”或“=”)。SeO32的空间构型是_____________________。
(3)NaN3是汽车安全气囊中的主要化学成分,其阴离子的立体构型为_____________。写出和该阴离子互为等电子体的一种分子的结构式_______________。
(4)钙和铁都是第四周期元素,且原子的最外层电子数相同,铁的熔沸点远高于钙,其原因是_____。
(5)配体中配位原子提供孤电子对的能力与元素的电负性有关,SCN-的结构式可以表示为[S=C=N]-或[S-C≡N]-,SCN-与Fe3+、Au+和Hg2+等离子能形成配离子,N、C、S的电负性依次为3.0、2.5和2.5。SCN-中提供孤电子对的原子可能是_______。
(6)某离子晶体XY2的晶胞结构如图所示。

①晶体中在每个X周围与它最近且距离相等的X共有_________个。
②设该晶体的摩尔质量为Mg·mol-1,晶胞的密度为ρg.cm-3,阿伏加德罗常数为NA,则晶体中两个最近的X间的距离为________cm。
【答案】3d104s24p1 哑铃形 < 三角锥形 直线形 O=C=O或N=N=O 钙原子半径较大且价电子数少,金属键较弱 S 12 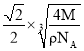
【解析】
(1)基态Ga原子与Al同主族,且比Al核外多18个电子,由此可写出核外电子排布式,基态Ga原子核外电子占据的最高能级的电子云,应为离核远、能级能量高的电子云;
(2)硒的含氧酸有H2SeO3,H2SeO4,比较二者酸性时,可从非羟基氧原子数进行分析;SeO32的价层电子对数为4,由此可确定其空间构型;
(3)NaN3的阴离子为N3-,中心N原子发生sp杂化,由此可确定其立体构型;和N3-互为等电子体的一种分子可用N周围的原子替换N原子进行寻找;
(4)钙和铁相比,原子的最外层电子数相同,但价电子数及原子半径有差异,导致铁的熔沸点远高于钙。
(5)配体中配位原子提供孤电子对的能力与元素的电负性有关,N、C、S的电负性依次为3.0、2.5和2.5。电负性越小的原子,越容易提供孤电子对。
(6)①晶体中在每个X周围与它最近且距离相等的X应为面心的X原子;
②晶体中两个最近的X,应为顶点与面心中两个X原子间的距离,可先求边长,再求距离。
(1) Ga原子与Al同主族,且比Al核外多18个电子,则基态Ga原子的核外电子排布式是[Ar] 3d104s24p1,基态Ga原子核外电子占据最高能级的电子云是4p,其轮廓图为哑铃形;答案为:3d104s24p1;哑铃形;
(2)硒的含氧酸有H2SeO3、H2SeO4,其非羟基氧原子数分别为1和2,所以酸性:H2SeO3<H2SeO4;SeO32的价层电子对数为4,则其空间构型是三角锥形;答案为:<;三角锥形;
(3) NaN3的阴离子为N3-,中心N原子发生sp杂化,则其立体构型为直线形;和N3-互为等电子体的一种分子的结构式为O=C=O或N=N=O;答案为:直线形;O=C=O或N=N=O;
(4)钙和铁相比,原子的最外层电子数相同,但铁的价电子数多、原子半径小,由此得出铁的熔沸点远高于钙,其原因是钙原子半径较大且价电子数少,金属键较弱;答案为:钙原子半径较大且价电子数少,金属键较弱;
(5)配体中配位原子提供孤电子对的能力与元素的电负性有关,N、C、S的电负性依次为3.0、2.5和2.5。电负性越小的原子,越容易提供孤电子对,所以SCN-中提供孤电子对的原子可能是S;答案为:S;
(6)①晶体中在每个X周围与它最近且距离相等的X应为面心的X原子,共有![]() =12个。答案为:12;
=12个。答案为:12;
②在1个晶胞中,含X离子个数为8×![]() +6
+6![]() =4,含Y离子的个数为8。设晶胞的参数为a,则a3=
=4,含Y离子的个数为8。设晶胞的参数为a,则a3=![]() ,a=
,a=![]() ,则晶体中两个最近的X间的距离为
,则晶体中两个最近的X间的距离为![]() a=
a=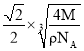 cm;答案为:
cm;答案为: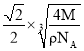 。
。


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
【题目】关于小苏打水溶液的表述正确的是( )
A. 存在的电离平衡为HCO3-+H2O![]() H2CO3+OH-
H2CO3+OH-
B. c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-)
C. HCO3-的电离程度大于HCO3-的水解程度
D. c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
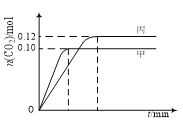
【题目】一定温度下,在三个容积均为2.0 L的恒容密闭容器中发生反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。各容器中起始物质的量与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随时间变化关系如下图所示。下列说法正确的是
N2(g)+2CO2(g)。各容器中起始物质的量与反应温度如下表所示,反应过程中甲、丙容器中CO2的物质的量随时间变化关系如下图所示。下列说法正确的是
容器 | 温度/℃ | 起始物质的量/mol | |
NO (g) | CO (g) | ||
甲 | T1 | 0.20 | 0.20 |
乙 | T1 | 0.30 | 0.30 |
丙 | T2 | 0.20 | 0.20 |
A. 该反应的正反应为吸热反应
B. 达到平衡时,乙中CO2的体积分数比甲中的大
C. T1℃时,若起始时向甲中充入0.40 mol NO、0.40mol CO、0.40mol N2和0.40mol CO2,则反应达到新平衡前v(正)<v(逆)
D. T2℃时,若起始时向丙中充入0.06mol N2和0.12 mol CO2,则达平衡时N2的转化率大于40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1mol/LNaOH溶液分别滴定体积均为20.00mL、浓度均为0.1mol/L的HX、HY溶液,pH随NaOH溶液体积变化如图。下列结论正确的是( )
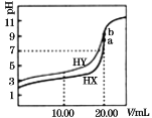
A.已知室温下某碱AOH的Kb=1×10-9,则AY的水溶液呈碱性
B.当加入10.00mL NaOH溶液时,有c(Na+)>c(HX)> c(X-)> c(H+)
C.pH=7时,c(Y-)=c(X-)
D.a、b两点溶液混合后,c(HX)+c(HY)+c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期的三种元素X、Y、Z,原子序数依次变小,原子核外电子层数之和是5。X元素原子最外电子层上的电子数是Y和Z两元素原子最外电子层上的电子数的总和;Y元素原子的最外电子层上的电子数是它的电子层数的2倍,X和Z可以形成XZ3的化合物。请完成下列问题:
(1)Z元素的名称是___。
(2)XZ3化合物的化学式是___,电子式是__。
(3)分别写出X、Y的含氧酸的化学式__、__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向10mL1mol·L-1的HCOOH溶液中不断滴加1mol·L-1的NaOH溶液,并一直保持常温,所加碱的体积与-lgc水(H+)的关系如图所示。c水(H+)为溶液中水电离的c(H+)。下列说法不正确的是( )
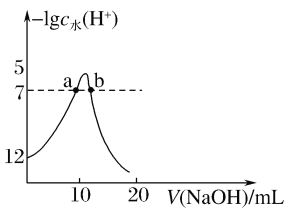
A.常温下,Ka(HCOOH)的数量级为10-4
B.a、b两点pH均为7
C.从a点到b点,水的电离程度先增大后减小
D.混合溶液的导电性逐渐增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,可用于各种纤维和某些食品的漂白。马蒂逊(Mathieson)法制备亚氯酸钠的流程如下:
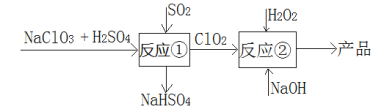
下列说法错误的是( )
A.反应①阶段,参加反应的NaClO3和SO2的物质的量之比为2:1
B.若反应①通过原电池来实现,则ClO2是正极产物
C.反应②中的H2O2可用NaClO4代替
D.反应②条件下,ClO2的氧化性大于H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 4NH3+5O2 = 4NO+6H2O(g),若反应速率分别用 v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系是( )
A.v(O2)=![]() v(NH3)B.v(H2O)=
v(NH3)B.v(H2O)= ![]() v(O2)C.v(H2O)=
v(O2)C.v(H2O)=![]() v(NH3)D.v(NO)=
v(NH3)D.v(NO)= ![]() v(O2)
v(O2)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com