
【题目】下列能发生酯化、加成、氧化、还原、消去5种反应的化合物是
A. CH2=CHCH2COOH
B. ![]()
C. ![]()
D. CH2=CH-CH2-CHO
科目:高中化学 来源: 题型:
【题目】D是一种催眠药,F是一种香料,它们的合成路线如下:

(1)A的化学名称是_____________,C中含氧官能团的名称为_____________。
(2)F的结构简式为____________________,A和E生成F的反应类型为______________。
(3)A生成B的化学方程式为__________________________________________________。
(4)写出由C合成D的第二个反应的化学方程式:_________________________________。
(5)同时满足下列条件的E的同分异构体有_________种(不含立体异构)。
①遇FeCl3溶液发生显色反应; ②能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚苯胺是一种在充放电过程中具有更优异可逆性的电极材料。Zn一聚苯胺二次电池的结构示意图如图所示,设NA为阿伏加德罗常数的值。下列说法错误的是( )
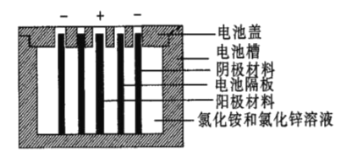
A.放电时,外电路每通过0.1NA个电子时,锌片的质量减少3.25g
B.充电时,聚苯胺电极的电势低于锌片的电势
C.放电时,混合液中的Cl-向负极移动
D.充电时,聚苯胺电极接电源的正极,发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确定Na2CO3和NaHCO3混合物样品的组成,称取四份该样品溶于水后分别逐滴加入相同浓度盐酸30.0 mL,充分反应,产生CO2的体积(已折算成标准状况下的体积,不考虑CO2在水中的溶解)如下表:
实验序号 | Ⅰ | Ⅱ | Ⅲ | Ⅳ |
盐酸体积(mL) | 30.0 | 30.0 | 30.0 | 30.0 |
样品质量(g) | 2.96 | 3.70 | 5.18 | 6.66 |
CO2体积(mL) | 672 | 840 | 896 | 672 |
(1)样品中的物质的量之比n(Na2CO3)∶n(NaHCO3)=________。
(2)盐酸的物质的量浓度c(HCl)=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2C2O4是一种二元弱酸。常温下向H2C2O4溶液中滴加KOH溶液,混合溶液中离子浓度与pH的关系如图所示,其中![]() 或
或![]() 。下列说法正确的是
。下列说法正确的是
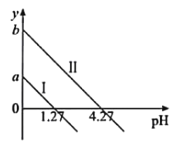
A.直线I表示的是![]() 与pH的变化关系
与pH的变化关系
B.图中纵坐标应该是a=1.27,b=4.27
C.c(![]() )>c(
)>c(![]() )>c(H2C2O4)对应1.27<pH<4.27
)>c(H2C2O4)对应1.27<pH<4.27
D.c(K+)=c(![]() )+c(
)+c(![]() )对应pH=7
)对应pH=7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取一支硬质大试管,通过排饱和食盐水的方法先后收集半试管甲烷和半试管氯气,并置于光亮处(如图),下列对于试管内发生的反应及现象的说法正确的是( )
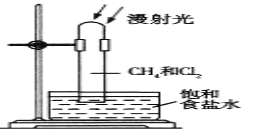
A. 反应过程中试管内黄绿色逐渐变浅,试管壁上有油珠产生
B. 将该装置放在黑暗处,![]() 与
与![]() 也能反应
也能反应
C. 该反应仅得到一种有机产物
D. ![]() 和
和![]() 完全反应后液面上升,液体充满试管
完全反应后液面上升,液体充满试管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酰紫草素具有抗菌、抗炎、抗病毒、抗肿瘤等作用,它的结构简式如图所示,下列有关乙酰紫草素的说法正确的是

A. 该分子中含有1个手性碳原子
B. 1mol乙酰紫草素最多可与2mol NaOH反应
C. 1mol 乙酰紫草素最多可与2mol Br2反应
D. 能与FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】形形色色的物质,构成了我们这个五彩缤纷的世界。世上万物,神奇莫测,常常超乎人们按“常理"的想象。学习物质结构和性质的知识,能使你想象的翅膀变得更加有力。
(1)基态Ga原子的核外电子排布式是[Ar]_____________,基态Ga原子核外电子占据最高能级的电子云轮廓图为___________。
(2)硒的含氧酸有H2SeO3,H2SeO4。酸性:H2SeO3____________H2SeO4(填“>”“<”或“=”)。SeO32的空间构型是_____________________。
(3)NaN3是汽车安全气囊中的主要化学成分,其阴离子的立体构型为_____________。写出和该阴离子互为等电子体的一种分子的结构式_______________。
(4)钙和铁都是第四周期元素,且原子的最外层电子数相同,铁的熔沸点远高于钙,其原因是_____。
(5)配体中配位原子提供孤电子对的能力与元素的电负性有关,SCN-的结构式可以表示为[S=C=N]-或[S-C≡N]-,SCN-与Fe3+、Au+和Hg2+等离子能形成配离子,N、C、S的电负性依次为3.0、2.5和2.5。SCN-中提供孤电子对的原子可能是_______。
(6)某离子晶体XY2的晶胞结构如图所示。

①晶体中在每个X周围与它最近且距离相等的X共有_________个。
②设该晶体的摩尔质量为Mg·mol-1,晶胞的密度为ρg.cm-3,阿伏加德罗常数为NA,则晶体中两个最近的X间的距离为________cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研小组利用硫铁矿(主要成分是FeS2,含Fe2O3、SiO2、Al2O3等杂质)制备重要的化工原料纳米Fe2O3的工艺流程如图所示。
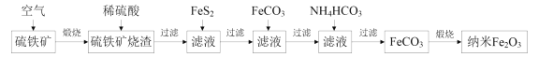
回答下列问题:
(1)煅烧前硫铁矿粉碎的目的是__,硫铁矿煅烧得到的气体需回收,该气体在工业上的主要用途是__。
(2)用稀硫酸浸取硫铁矿烧渣的主要反应的离子方程式为__,浸取后过滤得到的滤渣的化学式为__。
(3)加入FeS2的主要目的是还原滤液中的Fe3+,反应的化学方程式为:FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4,反应中每消耗1molFeS2,转移的电子数目为__,检验Fe3+是否完全被还原,应选择__(填标号)。
A.KMnO4溶液 B.K3[Fe(CN)6]溶液 C.KSCN溶液
(4)加FeCO3调溶液pH到5.8左右,其目的为__。
(5)加入NH4HCO3生成FeCO3的离子方程式为__,若煅烧得到160g纳米Fe2O3,则消耗的气体和生成的气体的物质的量之比为__。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com