
【题目】某科研小组利用硫铁矿(主要成分是FeS2,含Fe2O3、SiO2、Al2O3等杂质)制备重要的化工原料纳米Fe2O3的工艺流程如图所示。
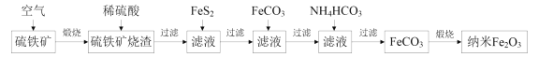
回答下列问题:
(1)煅烧前硫铁矿粉碎的目的是__,硫铁矿煅烧得到的气体需回收,该气体在工业上的主要用途是__。
(2)用稀硫酸浸取硫铁矿烧渣的主要反应的离子方程式为__,浸取后过滤得到的滤渣的化学式为__。
(3)加入FeS2的主要目的是还原滤液中的Fe3+,反应的化学方程式为:FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4,反应中每消耗1molFeS2,转移的电子数目为__,检验Fe3+是否完全被还原,应选择__(填标号)。
A.KMnO4溶液 B.K3[Fe(CN)6]溶液 C.KSCN溶液
(4)加FeCO3调溶液pH到5.8左右,其目的为__。
(5)加入NH4HCO3生成FeCO3的离子方程式为__,若煅烧得到160g纳米Fe2O3,则消耗的气体和生成的气体的物质的量之比为__。
【答案】增大接触面积,加快反应速率,使硫铁矿煅烧更加充分 工业制硫酸 Fe2O3+6H+=2Fe3++3H2O SiO2 14NA或8.428×1024 C 除去滤液中的Al3+ 2HCO3-+Fe2+=FeCO3↓+CO2↑+H2O 1:4
【解析】
硫铁矿煅烧,发生FeS2与O2反应生成Fe2O3和SO2,加硫酸,Al2O3、Fe2O3与硫酸反应,SiO2不与硫酸反应,根据流程目的是制备纳米Fe2O3,需要除去Al3+,因为Fe(OH)3的溶度积小于Al(OH)3的溶度积,因此先将Fe3+转化成Fe2+,加入FeS2的目的是将Fe3+转化成Fe2+,加入FeCO3调节pH,使Al3+以Al(OH)3形式除去,加入NH4HCO3,Fe2+与HCO3-反应生成FeCO3,煅烧FeCO3得到Fe2O3,逐步进行分析;
(1)煅烧前粉碎硫铁矿,增加硫铁矿与空气的接触面积,加快反应速率,使硫铁矿煅烧更加充分;FeS2与O2发生4FeS2+11O2=2Fe2O3+8SO2,利用SO2制备硫酸;
(2)硫铁矿煅烧后的烧渣为Fe2O3、Al2O3、SiO2,SiO2为酸性氧化物不与硫酸反应,Fe2O3与硫酸反应生成Fe2(SO4)3,Al2O3与硫酸反应生成Al2(SO4)3,烧渣中Fe2O3为主要物质,因此加入硫酸发生的主要反应是Fe2O3+6H+=2Fe3++3H2O;浸取后的滤渣为SiO2;
(3)根据反应方程式,FeS2中S由-1价转化成+6价,Fe2(SO4)3中Fe的化合价由+3价转化成+2价,因此消耗1molFeS2,转移电子物质的量为1mol×2×[6-(-1)]=14mol,即转移电子物质的量为14NA或8.428×1024;检验Fe3+是否完全被还原,则需要检验是否含有Fe3+,即用KSCN溶液检验,如果溶液不变红,则说明Fe3+完全反应,反之未完全反应,答案悬C;
(4)根据上述分析,加入FeCO3的目的是调节pH,使Al3+以Al(OH)3形式沉淀出来;
(5)加入NH4HCO3溶液得到FeCO3,即反应的离子方程式为2HCO3-+Fe2+=FeCO3↓+CO2↑+H2O;煅烧FeCO3得到Fe2O3反应方程式为4FeCO3+O2![]() 2Fe2O3+4CO2,消耗O2和生成CO2的物质的量之比为1:4。
2Fe2O3+4CO2,消耗O2和生成CO2的物质的量之比为1:4。


 能考试期末冲刺卷系列答案
能考试期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】向10mL1mol·L-1的HCOOH溶液中不断滴加1mol·L-1的NaOH溶液,并一直保持常温,所加碱的体积与-lgc水(H+)的关系如图所示。c水(H+)为溶液中水电离的c(H+)。下列说法不正确的是( )
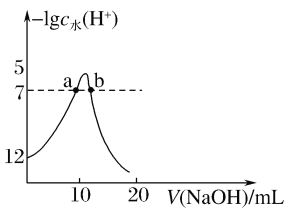
A.常温下,Ka(HCOOH)的数量级为10-4
B.a、b两点pH均为7
C.从a点到b点,水的电离程度先增大后减小
D.混合溶液的导电性逐渐增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,可用于各种纤维和某些食品的漂白。马蒂逊(Mathieson)法制备亚氯酸钠的流程如下:
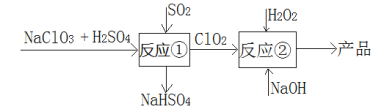
下列说法错误的是( )
A.反应①阶段,参加反应的NaClO3和SO2的物质的量之比为2:1
B.若反应①通过原电池来实现,则ClO2是正极产物
C.反应②中的H2O2可用NaClO4代替
D.反应②条件下,ClO2的氧化性大于H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳氧化物、氮氧化物、二氧化硫的处理与利用是世界各国研究的热点问题。汽车尾气中含有害的一氧化碳和一氧化氮,利用钯(Pd)等金属作催化剂可以迅速将二者转化为无害的二氧化碳和氮气。
(1)钯与镍位于同列,且在镍的下一周期,钯在元素周期表的位置是__,基态镍原子的价电子的电子排布图为__。
(2)C、N、O的第一电离能由大到小的顺序为__。
(3)SO2分子的VSEPR构型为__;SO3分子中心原子的杂化形式为__;N2O与CO2互为等电子体,且N2O分子中O只与一个N相连,N2O的空间构型为_,分子中的σ键和π键数目之比是__。
(4)大π键是3个或3个以上原子彼此平行的p轨道从侧面相互重叠形成的π键。一氧化氮分子中,氮与氧之间形成一个σ键、一个2电子π键与一个3电子π键,则3电子π键__(填“是”或“不是”)大π键;一氧化氮可与Fe2+生成棕色[Fe(H2O)5NO]2+离子,为检验亚铁离子的反应之一,[Fe(H2O)5NO]2+离子中配位体是__。
(5)CO可形成熔点为-20℃,沸点为103℃的配合物Fe(CO)5,Fe(CO)5分子中铁元素的化合价为___,属于__晶体。
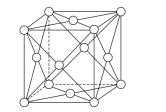
(6)钯晶体的晶胞如图,晶胞的边长为apm,NA表示阿伏加德罗常数的值,则钯单质的密度为___g/cm3(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.阅读下列材料后,回答相应问题:一个体重50kg的健康人的体内含铁2g。这2g铁在人体内不是以单质的形式存在的,而是以Fe2+和Fe3+的形式存在。Fe2+易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁(FeSO4)。服用维生素C,可使食物中的Fe3+转化为Fe2+,有利于铁的吸收。
⑴人体中经常进行![]() 的转化,A转化中Fe2+发生________(填“氧化”或“还原”,下同)反应,B转化中Fe3+做________剂。
的转化,A转化中Fe2+发生________(填“氧化”或“还原”,下同)反应,B转化中Fe3+做________剂。
⑵“服用维生素C,可使食物中的Fe3+转化为Fe2+”,这句话指出维生素C在这一反应中做________剂,具有________性。
Ⅱ.某化工厂排出的废液中含有Ag+、Ba2+、Cu2+三种金属阳离子,现欲用CO32-、OH-、Cl-三种不同的阴离子分别将上述金属阳离子逐一形成沉淀除去。加入阴离子的正确顺序是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 4NH3+5O2 = 4NO+6H2O(g),若反应速率分别用 v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系是( )
A.v(O2)=![]() v(NH3)B.v(H2O)=
v(NH3)B.v(H2O)= ![]() v(O2)C.v(H2O)=
v(O2)C.v(H2O)=![]() v(NH3)D.v(NO)=
v(NH3)D.v(NO)= ![]() v(O2)
v(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖颁给了三位为锂离子电池发展做出重要贡献的科学家。利用废旧二次电池[主要成分为Ni(OH)2、Fe2O3、MnO2、碳粉、铝箔等]合成电池级Ni(OH)2的工艺流程如下:
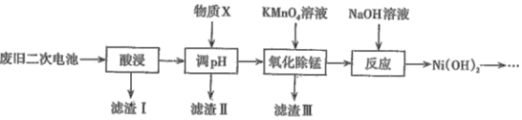
已知:
氢氧化物 | Fe(OH)3 | Al(OH)3 | Ni(OH)2 | Mn(OH)2 |
Ksp(室温下) | 4.0×10-38 | 1.0×10-33 | 1.6×10-14 | 2.0×10-13 |
(1)①已知“酸浸”后滤液中含有:Ni2+、Al3+、Fe3+、Mn2+,调节溶液的pH约为5,其目的是__;以下最适合作为物质X的是____(填字母)。
A.双氧水 B.氨水 C.盐酸 D.NiO
②若滤液中Ni2+的浓度为2molL-1,列式计算判断此时滤渣Ⅱ中是否有Ni(OH)2沉淀:___ 。
(2)滤渣Ⅲ的主要成分是____,“氧化除锰”过程发生反应的离子方程式为______。
(3)用Ni(OH)2和LiOH在空气中混合加热至700℃~800℃可制得LiNiO2(镍酸锂),该反应的化学方程式为___________。
(4)镍酸锂是一种有较好前景的锂离子电池正极材料。该电池在充放电过程中,发生LiNiO2和Li1-xNiO2之间的转化,充电时LiNiO2在_______(填“阴”或“阳“)极发生反应,该电极的电极反应式为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com