
【题目】Ⅰ.阅读下列材料后,回答相应问题:一个体重50kg的健康人的体内含铁2g。这2g铁在人体内不是以单质的形式存在的,而是以Fe2+和Fe3+的形式存在。Fe2+易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁(FeSO4)。服用维生素C,可使食物中的Fe3+转化为Fe2+,有利于铁的吸收。
⑴人体中经常进行![]() 的转化,A转化中Fe2+发生________(填“氧化”或“还原”,下同)反应,B转化中Fe3+做________剂。
的转化,A转化中Fe2+发生________(填“氧化”或“还原”,下同)反应,B转化中Fe3+做________剂。
⑵“服用维生素C,可使食物中的Fe3+转化为Fe2+”,这句话指出维生素C在这一反应中做________剂,具有________性。
Ⅱ.某化工厂排出的废液中含有Ag+、Ba2+、Cu2+三种金属阳离子,现欲用CO32-、OH-、Cl-三种不同的阴离子分别将上述金属阳离子逐一形成沉淀除去。加入阴离子的正确顺序是_____________。
【答案】氧化 氧化 还原 还原 Cl-、OH-、CO32-
【解析】
Ⅰ⑴人体中经常进行![]() 的转化,A转化中Fe2+化合价升高,B转化中Fe3+化合价降低。
的转化,A转化中Fe2+化合价升高,B转化中Fe3+化合价降低。
⑵“服用维生素C,可使食物中的Fe3+转化为Fe2+”,铁离子化合价降低,维生素C化合价升高。
Ⅱ.要将上述金属阳离子逐一形成沉淀除去,先加碳酸根,三种离子都要产生沉淀,先加氢氧根,银离子和铜离子形成沉淀,现加氯离子,银离子产生沉淀,根据分析得答案。
Ⅰ⑴人体中经常进行![]() 的转化,A转化中Fe2+化合价升高,发生氧化反应,B转化中Fe3+化合价降低,作氧化剂,故答案为:氧化;氧化。
的转化,A转化中Fe2+化合价升高,发生氧化反应,B转化中Fe3+化合价降低,作氧化剂,故答案为:氧化;氧化。
⑵“服用维生素C,可使食物中的Fe3+转化为Fe2+”,铁离子化合价降低,维生素C化合价升高,因此维生素C在这一反应中做还原剂,具有还原性,故答案为还原;还原。
Ⅱ.要将上述金属阳离子逐一形成沉淀除去,先加碳酸根,三种离子都要产生沉淀,先加氢氧根,银离子和铜离子形成沉淀,现加氯离子,银离子产生沉淀,因此先加氯离子沉淀银离子,再加氢氧根沉淀铜离子,最后加碳酸根沉淀钡离子,加入阴离子的正确顺序是Cl-、OH-、CO32-,故答案为:Cl-、OH-、CO32-。


科目:高中化学 来源: 题型:
【题目】乙酰紫草素具有抗菌、抗炎、抗病毒、抗肿瘤等作用,它的结构简式如图所示,下列有关乙酰紫草素的说法正确的是

A. 该分子中含有1个手性碳原子
B. 1mol乙酰紫草素最多可与2mol NaOH反应
C. 1mol 乙酰紫草素最多可与2mol Br2反应
D. 能与FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒是人体必需的微量元素,右图是硒在周期表中的信息,关于硒元素的说法错误的是

A. 位于第四周期
B. 质量数为34
C. 原子最外层有6个电子
D. 相对原子质量为78.96
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研小组利用硫铁矿(主要成分是FeS2,含Fe2O3、SiO2、Al2O3等杂质)制备重要的化工原料纳米Fe2O3的工艺流程如图所示。
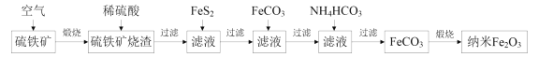
回答下列问题:
(1)煅烧前硫铁矿粉碎的目的是__,硫铁矿煅烧得到的气体需回收,该气体在工业上的主要用途是__。
(2)用稀硫酸浸取硫铁矿烧渣的主要反应的离子方程式为__,浸取后过滤得到的滤渣的化学式为__。
(3)加入FeS2的主要目的是还原滤液中的Fe3+,反应的化学方程式为:FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4,反应中每消耗1molFeS2,转移的电子数目为__,检验Fe3+是否完全被还原,应选择__(填标号)。
A.KMnO4溶液 B.K3[Fe(CN)6]溶液 C.KSCN溶液
(4)加FeCO3调溶液pH到5.8左右,其目的为__。
(5)加入NH4HCO3生成FeCO3的离子方程式为__,若煅烧得到160g纳米Fe2O3,则消耗的气体和生成的气体的物质的量之比为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色。填写下列空白:
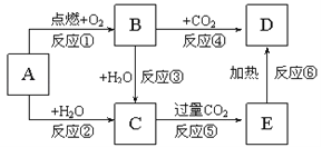
![]() 写出化学式:B__________,C______________,D __________________
写出化学式:B__________,C______________,D __________________
![]() 写出反应
写出反应![]() 的离子方程式:_______________________________________
的离子方程式:_______________________________________
![]() 写出反应
写出反应![]() 的化学反应方程式:_________________________________
的化学反应方程式:_________________________________
![]() 写出反应
写出反应![]() 的化学反应方程式,______________,若产生
的化学反应方程式,______________,若产生![]() 氧化产物,被还原的物质是__________,其物质的量是____mol,转移的电子数目______
氧化产物,被还原的物质是__________,其物质的量是____mol,转移的电子数目______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ca(NO2)2常用于电子、仪表及冶金工业。某化工厂采用下列方案制备Ca(NO2)2,并除去氮氧化物(大气污染物),工艺流程如图:
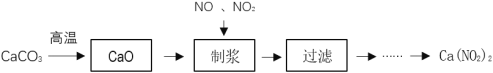
①NO2+NO+Ca(OH)2═Ca(NO2)2+H2O;4NO2+2Ca(OH)2═Ca(NO2)2+Ca(NO3)2+2H2O
②在酸性条件下2![]() +4H++2I-=2NO↑+I2+2H2O;2
+4H++2I-=2NO↑+I2+2H2O;2![]() +I2=
+I2=![]() +2I-
+2I-
(1)为加快CaCO3的分解速率,可以采取的措施有___(任写一种)。
(2) “制浆”过程中生成Ca(OH)2的化学方程式是___。
(3)该工艺流程中需控制NO和NO2物质的量之比接近1∶1。若n(NO2)∶n(NO)>1∶1,则会导致___。
(4)Ca(NO2)2样品纯度的测定
①准确称取1.50gCa(NO2)2样品配成250ml的溶液,取25mL于锥形瓶中,加入过量的KI溶液、淀粉溶液,滴加稀硫酸,溶液变蓝。
②用0.1mol·L-1Na2S2O3溶液滴定溶液至无色,消耗Na2S2O3溶液的体积为20.00mL,据此计算样品中Ca(NO2)2的纯度,写出计算过程___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意完成下列填空。
(1)a.金刚石和石墨 b.12C和13C c.CH4和C2H6 d.乙醇与二甲醚(填字母)
①互为同位素的是___;
②互为同素异形体的是___;
③互为同系物的是___;
④互为同分异构体的是___。
(2)请补充完下列方程式:
①CH4+Cl2![]() ___+HCl
___+HCl
②CH2=CH2+Br2→___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】缓冲溶液可以抗御少量酸碱对溶液pH的影响。人体血液里最主要的缓冲体系是碳酸氢盐缓冲体系(H2CO3/HCO3-),维持血液的pH保持稳定。己知在人体正常体温时,反应H2CO3![]() HCO3-+H+的Ka=10-6.1 ,正常人的血液中c(HCO3-):c(H2CO3)≈20:1,lg2=0.3。则下列判断正确的是
HCO3-+H+的Ka=10-6.1 ,正常人的血液中c(HCO3-):c(H2CO3)≈20:1,lg2=0.3。则下列判断正确的是
A.正常人血液内Kw=10-14
B.由题给数据可算得正常人血液的pH约为7.4
C.正常人血液中存在:c(HCO3-)+c(OH-)+2c(CO32-)=c(H+)+c(H2CO3)
D.当过量的碱进入血液中时,只有发生HCO3-+OH-=CO32-+H2O的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物1是一种常见的植物两味油,常用脂肪烃A和芳香烃D按如下路线合成:

已知:①R1CHO+R2CH2CHO![]()

![]()

②通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
回答下列问题:
(1)A的名称是___,H含有的官能团名称是_____。
(2)②的反应条件是___。⑦的反应类型是______。
(3)I的结构简式是________。
(4)④的化学方程式是_________。
(5)L是I的同分异构体且含有相同官能团,其结构中苯环上只有两个处于对位的取代基,则L共有_种(不考虑立体异构)
(6)参照以上合成路线,设计以C为原料制备保水树脂 的合成路线(无机试剂任选)__ 。
的合成路线(无机试剂任选)__ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com