
【题目】下列图示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色。填写下列空白:
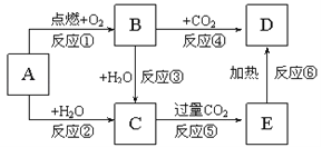
![]() 写出化学式:B__________,C______________,D __________________
写出化学式:B__________,C______________,D __________________
![]() 写出反应
写出反应![]() 的离子方程式:_______________________________________
的离子方程式:_______________________________________
![]() 写出反应
写出反应![]() 的化学反应方程式:_________________________________
的化学反应方程式:_________________________________
![]() 写出反应
写出反应![]() 的化学反应方程式,______________,若产生
的化学反应方程式,______________,若产生![]() 氧化产物,被还原的物质是__________,其物质的量是____mol,转移的电子数目______
氧化产物,被还原的物质是__________,其物质的量是____mol,转移的电子数目______
【答案】Na2O2 NaOH Na2CO3 ![]()
![]() 2Na2O2+2CO2=2Na2CO3+O2
2Na2O2+2CO2=2Na2CO3+O2 ![]()
![]()
![]()
【解析】
A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色,则A是Na,根据转化关系知,B是Na2O2、C是NaOH、D是Na2CO3、E是NaHCO3,以此解答该题。
(1)通过以上分析知,B是Na2O2,C是NaOH,D是Na2CO3;答案为Na2O2,NaOH,Na2CO3。
(2)NaOH溶液和过量二氧化碳反应生成碳酸氢钠,其离子方程式为CO2+OH-=HCO3-;答案为CO2+OH-=HCO3-。
(3)NaHCO3受热分解,生成Na2CO3、CO2和H2O,其化学方程式为2NaHCO3 ![]() Na2CO3+CO2↑+H2O;答案为2NaHCO3
Na2CO3+CO2↑+H2O;答案为2NaHCO3 ![]() Na2CO3+CO2↑+H2O。
Na2CO3+CO2↑+H2O。
(4)反应④是Na2O2与CO2反应生成Na2CO3和O2,其化学方程式为2Na2O2+2CO2=2Na2CO3+O2,根据此化学方程式分析,4个-1价的氧,2个失2个电子化合价升高到0价为O2,2个得2个电子变成-2价氧,因而Na2O2既是氧化剂又是还原剂,且2摩尔的Na2O2中有1摩尔氧化剂,1摩尔还原剂,O2是氧化产物,被还原的物质是Na2O2,若产生![]() 氧化产物,被还原的Na2O2也是0.5mol,生成1molO2,转移2mol电子,生成0.5molO2,转移的电子为1摩尔,即转移的电子数目为NA个;答案为2Na2O2+2CO2=2Na2CO3+O2,Na2O2,0.5mol,NA。
氧化产物,被还原的Na2O2也是0.5mol,生成1molO2,转移2mol电子,生成0.5molO2,转移的电子为1摩尔,即转移的电子数目为NA个;答案为2Na2O2+2CO2=2Na2CO3+O2,Na2O2,0.5mol,NA。


科目:高中化学 来源: 题型:
【题目】有原子序数依次增大的A、B、C、D、E五种前四周期元素,B元素原子有三个能级,且每个能级上的电子数相等;C原子的p轨道处于半充满状态,D的单质是空气的主要成分之一,其质子数为A与C之和;E在周期表中位于ds区,且与D可形成化学式为E2D或ED的二元化合物。请回答下列问题:
(1)E元素基态原子的M能层中具有_____个能级,该元素的常见化合价有多种,其中E+的简化电子排布式为__________。
A.[Ar]3d104s1 B.[Ar]3d10 C.[Ar]3d94s1 D.[Ar]3d84s2
(2)元素C和D的原子的第一电离能较大的为__________(填元素符号),其原因是____________________;C与A可形成一种常见的气态化合物,该化合物的空间构型为____________________,其中C原子的杂化轨道类型为____________________。
(3)C2在日常生活及工农业生产等领域用途非常广泛,其分子结构中σ键和π键数目之比是_______;C2D与BD2互为__________(填“等电子体”或“非等电子体”),其理由是____________________。
(4)在E催化下,分子式为BA4D的化合物可被氧化为分子式为BA2D的化合物,则BA2D分子中键角约为__________;BA4D和BA2D两化合物均易溶于水,是由于与水分子间形成了__________键的缘故。
(5)元素E的单质晶体在不同温度下可有两种堆积方式,晶胞分别如图a和b所示,则其面心立方堆积的晶胞与体心立方堆积的晶胞中实际含有的E原子的个数之比为__________;元素B的单质晶体结构有多种,其中一种硬度很大,结构如下图,则该单质晶体的熔点_______E单质晶体的熔点(填“高于”或“低于”);若B单质的原子(如图中A、B两原子)在体对角线上外切,晶胞参数为a,则该晶体的空间利用率约为__________。(百分数表示,取两位有效数字)(已知![]() =1.732)
=1.732)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是石油裂解气的主要成分,它的产量通常用来衡量一个国家的石油化工水平。请回答:
(1)乙烯的结构简式为__________。
(2)下列可以鉴别甲烷和乙烯的试剂为__________(填选项字母)。
A.稀硫酸 B.溴的四氯化碳溶液 C.水 D.酸性高锰酸钾溶液
(3)下列物质中,不能通过乙烯加成反应得到的是__________(填选项字母)。
A.CH3CH3 B.CH3CHCl2 C.CH3CH2OH D.CH3CH2Br
(4)以乙烯为主要原料合成乙酸,B能发生银镜反应。合成线路如图所示:
![]()
反应①的化学方程式为__________。反应③的反应类型为__________反应(填有机反应基本反应类型)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成气(CO、H2)是一种重要的化工原料气。合成气制取有多种方法,如煤的气化、天然气部分氧化等。回答下列问题:
I.合成气的制取
(1)煤的气化制取合成气。
已知:①H2O(g)=H2O(l) △H=-44kJ/mol;
②部分物质的燃烧热:
![]()
则反应C(s)+H2O(g)![]() CO(g)+H2(g)的△H=___kJ/mol。
CO(g)+H2(g)的△H=___kJ/mol。
(2)天然气部分氧化制取合成气。
如果用O2(g)、H2O(g)、CO2(g)混合物氧化CH4(g),欲使制得的合成气中CO和H2的物质的量之比为1︰2,则原混合物中H2O(g)与CO2(g)的物质的量之比为__。
Ⅱ.利用合成气合成乙醇
在一定条件下,向容积为2L的恒容密闭容器中投入2molCO和4molH2,发生反应:2CO(g)+4H2(g)![]() CH3CH2OH(g)+H2O(g)。
CH3CH2OH(g)+H2O(g)。
(1)写出该反应的平衡常数表达式__。
(2)下列情况能作为判断反应体系达到平衡的标志是__(填序号)。
A.压强不再变化 B.平均摩尔质量不再变化 C.密度不再变化
(3)反应起始压强记为p1、平衡后记为p2,平衡时H2的转化率为__。(用含p1、p2的代数式表示)
Ⅲ.合成乙醇的条件选择
为探究合成气制取乙醇的适宜条件,某科研团队对不同温度、不同Rh质量分数的催化剂对CO的吸附强度进行了研究,实验数据如图。CO的非离解吸附是指CO尚未乙醇化,离解吸附是指CO已经乙醇化。
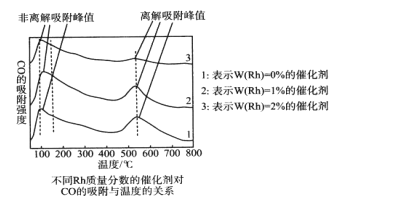
(1)结合图像从低温区、高温区分析温度对CO吸附强度的影响__;以及催化剂对CO吸附强度的影响__。
(2)用Rh作催化剂,合成气制取乙醇的适宜温度是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.阅读下列材料后,回答相应问题:一个体重50kg的健康人的体内含铁2g。这2g铁在人体内不是以单质的形式存在的,而是以Fe2+和Fe3+的形式存在。Fe2+易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁(FeSO4)。服用维生素C,可使食物中的Fe3+转化为Fe2+,有利于铁的吸收。
⑴人体中经常进行![]() 的转化,A转化中Fe2+发生________(填“氧化”或“还原”,下同)反应,B转化中Fe3+做________剂。
的转化,A转化中Fe2+发生________(填“氧化”或“还原”,下同)反应,B转化中Fe3+做________剂。
⑵“服用维生素C,可使食物中的Fe3+转化为Fe2+”,这句话指出维生素C在这一反应中做________剂,具有________性。
Ⅱ.某化工厂排出的废液中含有Ag+、Ba2+、Cu2+三种金属阳离子,现欲用CO32-、OH-、Cl-三种不同的阴离子分别将上述金属阳离子逐一形成沉淀除去。加入阴离子的正确顺序是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请阅读下列材料,完成下面小题。
联合国将2019年定为“国际化学元素周期表年”以纪念门捷列夫发现元素周期律150周年。元素周期律把元素及其化合物纳入一个统一的理论体系,为系统研究元素及其化合物提供了科学方法,为发现和探索新元素、新物质提供了有效思路。
1. 为纪念门捷列夫,科学家将1955年人工合成的一种新元素用符号“Md”表示,中文命名为“钔”。核素![]() Md的中子数为(______)
Md的中子数为(______)
A. 101 B. 359 C. 258 D. 157
2. O和S都属于元素周期表ⅥA元素,它们原子结构中相同的是(______)
A. 质子数 B. 电子层数 C. 电子数 D. 最外层电子数
3. 锂是第2周期ⅠA族元素,下列有关锂元素性质推测正确的是(______)
A. 金属性比钠弱
B. 最高化合价为+2
C. 单质与水的反应比钠更剧烈
D. 原子半径比钠的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大气中CO2含量的增多除了导致地球表面温度升高外,还会影响海洋生态环境。某研究小组在实验室测得不同温度下(T1,T2)海水中CO32-浓度与模拟空气中CO2浓度的关系曲线。已知:海水中存在以下平衡:CO2(aq)+CO32-(aq)+H2O(aq)![]() 2HCO3-(aq),下列说法不正确的是
2HCO3-(aq),下列说法不正确的是
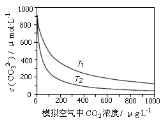
A.T1>T2
B.海水温度一定时,大气中CO2浓度增加,海水中溶解的CO2随之增大,CO32-浓度降低
C.当大气中CO2浓度确定时,海水温度越高,CO32- 浓度越低
D.大气中CO2含量增加时,海水中的珊瑚礁将逐渐溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烷的分子结构可简写成键线式结构![]() ,有机物A的键线式结构为
,有机物A的键线式结构为![]() ,有机物B与等物质的量的H2发生加成反应可得到有机物A,下列有关说法错误的是( )
,有机物B与等物质的量的H2发生加成反应可得到有机物A,下列有关说法错误的是( )
A. 有机物A的一氯代物只有4种
B. 用系统命名法命名有机物A,名称为2,2,3-三甲基戊烷
C. 有机物A的分子式为C8H18
D. B的结构可能有3种,其中一种的名称为3,4,4-三甲基-2-戊烯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com