
【题目】请阅读下列材料,完成下面小题。
联合国将2019年定为“国际化学元素周期表年”以纪念门捷列夫发现元素周期律150周年。元素周期律把元素及其化合物纳入一个统一的理论体系,为系统研究元素及其化合物提供了科学方法,为发现和探索新元素、新物质提供了有效思路。
1. 为纪念门捷列夫,科学家将1955年人工合成的一种新元素用符号“Md”表示,中文命名为“钔”。核素![]() Md的中子数为(______)
Md的中子数为(______)
A. 101 B. 359 C. 258 D. 157
2. O和S都属于元素周期表ⅥA元素,它们原子结构中相同的是(______)
A. 质子数 B. 电子层数 C. 电子数 D. 最外层电子数
3. 锂是第2周期ⅠA族元素,下列有关锂元素性质推测正确的是(______)
A. 金属性比钠弱
B. 最高化合价为+2
C. 单质与水的反应比钠更剧烈
D. 原子半径比钠的大
【答案】D D A
【解析】
【1】
核素![]() Md的左下角数字101表示质子数,左上角数字258表示质量数,对于一个核素来说,质量数=质子数+中子数,所以中子数=质量数-质子数=258-101=157,故选D。
Md的左下角数字101表示质子数,左上角数字258表示质量数,对于一个核素来说,质量数=质子数+中子数,所以中子数=质量数-质子数=258-101=157,故选D。
【2】
A.O和S的质子数分别为8和16,二者的质子数不相等,A不合题意;
B.O和S的电子层数分别为2和3,二者的电子层数不相等,B不合题意;
C.O和S的电子数分别为8和16,二者的电子数不相等,C不合题意;
D.O和S的最外层电子数都为6,二者的最外层电子数相等,D符合题意;
故选D。
【3】
A.锂与钠是同主族元素,锂在钠的上方,金属性比钠弱,A正确;
B.锂是第二周期ⅠA族元素,最外层只有1个电子,最高化合价为+1价,B不正确;
C.锂的金属性比钠弱,所以单质与水的反应比钠慢,C不正确;
D.锂与钠同主族,且比钠少1个电子层,所以原子半径比钠小,D不正确;
故选A。


科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为原子序数依次增大的短周期元素,其中W原子的质子数是其M层电子数的三倍,Z与W、X与Y相邻,X与W同主族。下列说法不正确的是( )
A.原子半径:W>Z>Y>X
B.最高价氧化物对应水化物的酸性:X>W>Z
C.最简单气态氢化物的热稳定性:Y>X>W>Z
D.元素X、Z、W的最高化合价分别与其主族序数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示中,A为一种常见的单质,B、C、D、E是含A元素的常见化合物,它们的焰色反应均为黄色。填写下列空白:
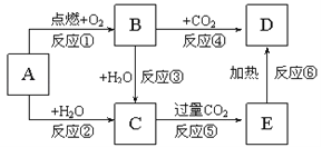
![]() 写出化学式:B__________,C______________,D __________________
写出化学式:B__________,C______________,D __________________
![]() 写出反应
写出反应![]() 的离子方程式:_______________________________________
的离子方程式:_______________________________________
![]() 写出反应
写出反应![]() 的化学反应方程式:_________________________________
的化学反应方程式:_________________________________
![]() 写出反应
写出反应![]() 的化学反应方程式,______________,若产生
的化学反应方程式,______________,若产生![]() 氧化产物,被还原的物质是__________,其物质的量是____mol,转移的电子数目______
氧化产物,被还原的物质是__________,其物质的量是____mol,转移的电子数目______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.SiO2制成的玻璃纤维,由于导电能力强而被用于制造通讯光缆
B.水分子中O-H键的键能很大,因此水的沸点较高
C.Na2O2中 既含有离子键又含有共价键,但Na2O2属于离子化合物
D.1 mol NH3中含有共用电子对数为4NA (NA为阿伏加德罗常数的值)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意完成下列填空。
(1)a.金刚石和石墨 b.12C和13C c.CH4和C2H6 d.乙醇与二甲醚(填字母)
①互为同位素的是___;
②互为同素异形体的是___;
③互为同系物的是___;
④互为同分异构体的是___。
(2)请补充完下列方程式:
①CH4+Cl2![]() ___+HCl
___+HCl
②CH2=CH2+Br2→___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)⑧的原子结构示意图为_________;
(2)②的气态氢化物分子的结构式为___________,②和⑦的气态氢化物的稳定性相比,其中较弱的是____ (用该氢化物的化学式表示);
(3)②、③的最高价含氧酸的酸性由强到弱的顺序是____(填化学式);
(4)⑤、⑥元素的金属性强弱依次为___________(填“增大”、“减小”或“不变”);
(5)④、⑤、⑥的形成的简单离子半径依次_________(填“增大”、“减小”或“不变”);
(6)①、④、⑤元素可形成既含离子键又含共价键的化合物,写出它的电子式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下,下列说法错误的是( )
实验 序号 | 实验温度T/K | 参加反应的物质 | 溶液颜色褪至无色时所需时间t/s | ||||
KMnO4溶液(含硫酸) | H2C2O4溶液 | H2O | |||||
V/mL | c/mol·L-1 | V/mL | c/mol·L-1 | V/mL | |||
A | 293 | 4 | 0.02 | 6 | 0.1 | 0 | 6 |
B | 293 | 4 | 0.02 | 4 | 0.1 | V1 | 8 |
C | T1 | 4 | 0.02 | 6 | 0.1 | 0 | 5 |
A.时间t的意义是,从溶液混合到KMnO4颜色褪去的时间
B.实验C中5s内平均反应速率v(KMnO4)=1.6×10-3molL-1s-1
C.实验A和B是探究
D.实验A和C是探究温度对反应速率的影响,则T1>293
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠、铝是两种重要的金属,其单质及化合物在人们的日常生活、生产及科学研究中具有广泛的用途。回答下列问题:
(1)基态铝原子的电子排布图是____________________。
(2)与Al3+具有相同的电子层结构的简单阴离子有__________(填离子符号),其中形成这些阴离子的元素中,电负性最强的是__________(填元素符号,下同),第一电离能最小的是__________。
(3)Al、Cl的电负性如下表:
元素 | Al | Cl |
电负性 | 1.5 | 3.0 |
则AlCl3为________晶体(填晶体类型);AlCl3升华后蒸气的相对分子质量约为267,则该蒸气分子的结构式是____________(标明配位键)。
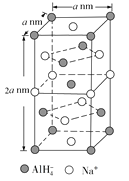
(4)氢化铝钠(NaAlH4)是重要的有机合成中还原剂。
①![]() 的空间构型为____________。
的空间构型为____________。
②NaAlH4的晶胞如下图所示,与Na+紧邻且等距的![]() 有________个;NaAlH4晶体的密度为________g/cm3(用含a 的代数式表示,NA代表阿伏加德罗常数)。
有________个;NaAlH4晶体的密度为________g/cm3(用含a 的代数式表示,NA代表阿伏加德罗常数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com