
【题目】根皮素J (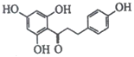 )是一种新型天然美白剂,主要分布于苹果、梨等多汁水果的果皮及根皮.其中一种合成J的路线如下:
)是一种新型天然美白剂,主要分布于苹果、梨等多汁水果的果皮及根皮.其中一种合成J的路线如下:
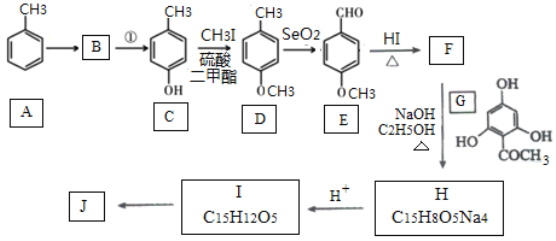
已知:
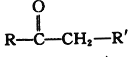 +R"CHO
+R"CHO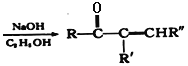 +H2O
+H2O
回答下列问题:
(1)C的化学名称是___________.E中官能团的名称为_______________.
(2)B为溴代烃,请写出A→B的反应试剂___________.
(3)写出由C生成D的反应类型___________
(4)F→H的化学方程式为______________________.
(5)M是E的同分异构体,同时符合下列条件的M的结构有___________种(不考虑立体异构)
①能与FeCl3溶液发生显色反应
②能发生银镜反应
(6)设计以丙烯和1,3-丙二醛为起始原料制备![]() 的合成路线_______(无机试剂任选).
的合成路线_______(无机试剂任选).
【答案】对甲基苯酚或4-甲基苯酚 醛基、醚键 铁、液溴 取代反应 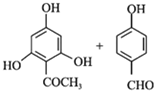 +4NaOH
+4NaOH![]()
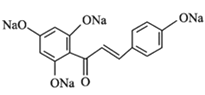 +5H2O 13
+5H2O 13 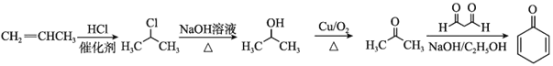
【解析】
(2)-(5)中B为溴代烃,对比A、B的结构可知,A与溴在Fe作催化剂条件下发生取代反应生成B,B发生卤代烃的水解反应生成C,故B为![]() ;C与CH3I发生取代反应生成D,D中发生氧化反应生成E;由G的结构简式、H的化学式、J的结构简式,可知F与G之间先脱去1分子水,然后酚羟基再与NaOH发生中和反应,可知脱水产物含有4个酚羟基,而J的分子中比I的多2个H原子,可知E与HI反应又引入酚羟基得到F,F的醛基与G中甲基之间脱去1分子水,故F为
;C与CH3I发生取代反应生成D,D中发生氧化反应生成E;由G的结构简式、H的化学式、J的结构简式,可知F与G之间先脱去1分子水,然后酚羟基再与NaOH发生中和反应,可知脱水产物含有4个酚羟基,而J的分子中比I的多2个H原子,可知E与HI反应又引入酚羟基得到F,F的醛基与G中甲基之间脱去1分子水,故F为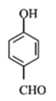 、H为
、H为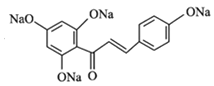 ,则I为
,则I为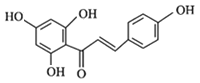 ,I中碳碳双键与氢气发生加成反应生成J。
,I中碳碳双键与氢气发生加成反应生成J。
(6)由F→H可知,![]() 与OHCCH2CHO反应生成
与OHCCH2CHO反应生成![]() ;丙烯与HCl发生加成反应生成CH3CHClCH3,然后水解生成
;丙烯与HCl发生加成反应生成CH3CHClCH3,然后水解生成![]() ,再发生氧化反应生成
,再发生氧化反应生成![]() 。
。
(1)根据C的结构简式,其化学名称是对甲基苯酚或4-甲基苯酚;根据结构简式可知,E中官能团的名称为醛基、醚键。
(2)B为溴代烃,其结构简式![]() ,A→B的反应条件为铁、液溴。
,A→B的反应条件为铁、液溴。
(3)由C生成D是酚羟基中氢原子被甲基替代,即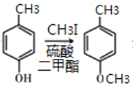 的反应类型为取代反应。
的反应类型为取代反应。
(4)F →H
→H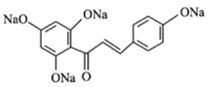 根据已知条件的反应机理可知反应方程式为
根据已知条件的反应机理可知反应方程式为 +4NaOH
+4NaOH![]()
 +5H2O。
+5H2O。
(5)M是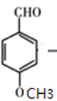 的同分异构体, ①能与FeCl3溶液发生显色反应说明结构中含酚羟基,②能发生银镜反应说明结构中有醛基,故M的结构有
的同分异构体, ①能与FeCl3溶液发生显色反应说明结构中含酚羟基,②能发生银镜反应说明结构中有醛基,故M的结构有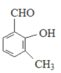 (移动-CH3,3种),
(移动-CH3,3种),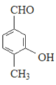 (移动-CH3,3种),
(移动-CH3,3种),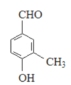 (移动-CH3,2种),
(移动-CH3,2种),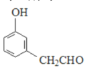 (移动-CH2CHO,3种),共13种。
(移动-CH2CHO,3种),共13种。
(6)结合题中已知 ,由丙烯和1,3-丙二醛制备![]() ,需要由丙烯制得丙酮,丙酮与1,3-丙二醛发生已知信息种的反应得到
,需要由丙烯制得丙酮,丙酮与1,3-丙二醛发生已知信息种的反应得到![]() ,合成路线为:
,合成路线为: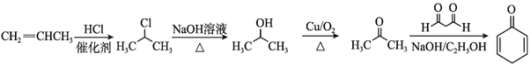 。
。


科目:高中化学 来源: 题型:
【题目】如图所示装置中观察到电流计指针偏转,M棒变粗、N棒变细,以此判断下表中所列M、N、P物质,其中可以成立的是

选项 | M | N | P |
A | 锌 | 铜 | 稀硫酸溶液 |
B | 铜 | 铁 | 稀盐酸溶液 |
C | 银 | 锌 | 硝酸银溶液 |
D | 锌 | 铁 | 硝酸铁溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有机化合物A、B、C、D、E存在下图所示转化关系,且C能跟NaHCO3发生反应,C和D的相对分子质量相等,E为无支链的化合物。
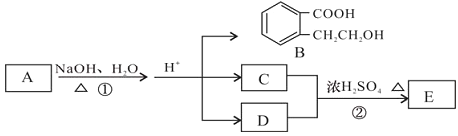
请回答下列问题:
(1)已知E的相对分子质量为102,其中碳、氢两种元素的质量分数分别为58.8%、9.8%,其余为氧,则E的分子式为_________________。
(2)B在一定条件下可以发生缩聚反应生成某高分子化合物,此高分子化合物的结构简式为_________________。
(3)D也可以由溴代烃F在NaOH溶液中加热来制取,写出此反应的化学方程式_________________。
(4)反应①的化学方程式_________________。
(5)B有多种同分异构体,请写出一种同时符合下列四个条件的结构简式:_________________。
a.能够发生水解
b.能发生银镜反应
c.能够与FeCl3溶液显紫色
d.苯环上的一氯代物只有一种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C原子序数依次递增,它们的原子的最外层电子数之和为10。A与C在周期表中同主族,B原子最外层电子数等于A原子次外层电子数。下列叙述正确的是( )
A. 原子半径A<B<C
B. A的氢化物的稳定性小于C的氢化物的稳定性
C. C的氧化物的熔点比A的氧化物的低
D. A与C可形成原子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种短周期元素在元素周期表中的相对位置如图所示。下列说法正确的是
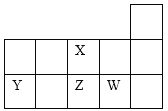
A.Y、Z、X三种元素的原子半径依次增大
B.X、Z都是第二周期ⅥA族元素,单质的氧化性X>Z
C.Y的气态氢化物的热稳定性比Z的高
D.W元素最高价氧化物的水化物的酸性比Z的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于小苏打水溶液的表述正确的是( )
A. 存在的电离平衡为HCO3-+H2O![]() H2CO3+OH-
H2CO3+OH-
B. c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-)
C. HCO3-的电离程度大于HCO3-的水解程度
D. c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法不正确的是
A.标准状况下,22.4 L Cl2与水充分反应,转移电子数为NA
B.31 g P4(分子结构:![]() )中的共价键数目为1.5NA
)中的共价键数目为1.5NA
C.30 g甲醛、乙酸的混合物完全燃烧,产生的CO2分子数目为NA
D.1 L 0.5 mol·L-1的Na2CO3溶液中含有的阴离子总数大于0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲硅烷广泛用于电子工业、汽车领域,三氯氢硅(![]() )是制备甲硅烷的重要原料。回答下列问题:
)是制备甲硅烷的重要原料。回答下列问题:
(1)工业上以硅粉和氯化氢气体为原料生产![]() 时伴随发生的反应有:
时伴随发生的反应有:
①![]()
②![]()
以硅粉和氯化氢气体生产![]() 的热化学方程式是_______________________。
的热化学方程式是_______________________。
(2)工业上可用四氯化硅和氢化铝锂(![]() )制甲硅烷,反应后得甲硅烷及两种盐。该反应的化学方程式为_________________________________________________。
)制甲硅烷,反应后得甲硅烷及两种盐。该反应的化学方程式为_________________________________________________。
(3)三氯氢硅歧化也可制得甲硅烷。反应![]() 为歧化制甲硅烷过程的关键步骤,此反应采用一定量的
为歧化制甲硅烷过程的关键步骤,此反应采用一定量的![]() 催化剂,在不同反应温度下测得
催化剂,在不同反应温度下测得![]() 的转化率随时间的变化关系如图所示。
的转化率随时间的变化关系如图所示。
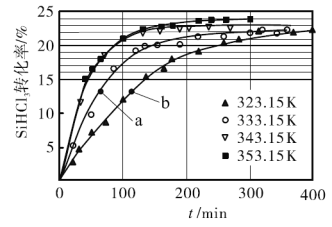
①![]() 时,平衡转化率为_________。该反应是__________反应(填“放热”或“吸热”)。
时,平衡转化率为_________。该反应是__________反应(填“放热”或“吸热”)。
②![]() 时,要缩短反应达到平衡的时间,可采取的措施有________________________。(答一种即可)
时,要缩短反应达到平衡的时间,可采取的措施有________________________。(答一种即可)
③比较a、b处反应速率的大小:![]() _______________
_______________![]() (填“>”“<”或“=”)。已知反应速率
(填“>”“<”或“=”)。已知反应速率![]() 分别是正、逆反应的速率常数,与反应温度有关,x为物质的量分数,则在
分别是正、逆反应的速率常数,与反应温度有关,x为物质的量分数,则在![]() 时
时![]() ___________(保留3位小数)。
___________(保留3位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1mol/LNaOH溶液分别滴定体积均为20.00mL、浓度均为0.1mol/L的HX、HY溶液,pH随NaOH溶液体积变化如图。下列结论正确的是( )
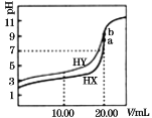
A.已知室温下某碱AOH的Kb=1×10-9,则AY的水溶液呈碱性
B.当加入10.00mL NaOH溶液时,有c(Na+)>c(HX)> c(X-)> c(H+)
C.pH=7时,c(Y-)=c(X-)
D.a、b两点溶液混合后,c(HX)+c(HY)+c(H+)=c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com