
【题目】加碘食盐中含碘酸钾(KIO3),化学兴趣小组对加碘食盐展开研究性学习。
(1)加碘食盐中KIO3的制备可以采用以下两种方法:
方法一:碘单质与KClO3溶液反应生成KIO3和Cl2;
方法二:碘单质与H2O2在催化剂作用下反应生成HIO3,再与K2CO3作用生成KIO3;两种方法制等质量的KIO3,理论上消耗KClO3和H2O2的物质的量之比为 _______ 。
(2)兴趣小组测定食用精制盐中碘元素含量的实验步骤为:
步骤1:准确称取25.00 g食盐,加适量蒸馏水使其完全溶解,配成100.00 mL溶液;
步骤2:取所配溶液25.00 mL于锥形瓶中,用稀硫酸酸化该溶液,加入足量KI溶液,使之充分反应;
步骤3:滴入2~3滴淀粉溶液作指示剂,用1.0×10-3 mol·L-1的Na2S2O3标准溶液滴定至终点,恰好完全反应时消耗12.00 mL标准溶液。
已知步骤3中所发生反应的离子方程式为I2+2S2O32-=2I-+S4O62-。
①步骤3中滴定终点的现象是 _______ 。
②下列情况会使测定结果偏大的是 _______ 。
A 装Na2S2O3标准溶液的滴定管水洗后未用Na2S2O3标准溶液润洗
B 装Na2S2O3标准溶液的滴定管滴定前有气泡,滴定终了无气泡
C 滴定时未充分振荡,溶液局部变色就终止
D 若其他读数正确,滴定结束读数时俯视
③计算该精制盐的碘元素含量(mg·kg-1),写出计算过程_______。
【答案】2∶5 溶液蓝色恰好褪去,且半分钟内不变色 AB n(Na2S2O3)= 1.0×10-3mol·L-1×12.00×10-3L=12.0×10-6mol
由关系式可知:I2~2Na2S2O3
n(I2)=6.0×10-6mol
根据方程式:IO3-+5I-+6H+=3I2+3H2O
n(IO3-)= 2.0×10-6mol
20.00 g食盐中碘元素的物质的量n(I) =2.0×10-6mol×4=8.0×10-6mol
20.00 g食盐中碘元素的质量m(I) =8.0×10-6mol×127 g·mol-1=1.016×10-3g
碘元素的含量=![]() =40.64 mg·kg-1
=40.64 mg·kg-1
n(Na2S2O3)= 1.0×10-3mol·L-1×12.00×10-3L=12.0×10-6mol
由关系式可知:I2~2Na2S2O3
n(I2)=6.0×10-6mol
根据方程式:IO3-+5I-+6H+=3I2+3H2O
n(IO3-)= 2.0×10-6mol
20.00 g食盐中碘元素的物质的量n(I) =2.0×10-6mol×4=8.0×10-6mol
20.00 g食盐中碘元素的质量m(I) =8.0×10-6mol×127 g·mol-1=1.016×10-3g
碘元素的含量=![]() =40.64 mg·kg-1
=40.64 mg·kg-1
【解析】
(1)两种方法要制得等质量的KIO3,根据电子守恒,KClO3和H2O2得电子数应相等,据此计算KClO3和H2O2的物质的量之比;
(2)①步骤2中发生反应:IO3-+5I-+6H+===3I2+3H2O,步骤3用Na2S2O3标准溶液滴定生成的I2,反应完时,I2消失,滴入的淀粉溶液蓝色退去;
②如果某操作引起代入计算的Na2S2O3标准溶液体积偏大,则造成I2测定结果偏大,从而造成食用精制盐中碘元素含量偏大,据此进行分析;
③根据反应I2+2S2O32-=2I-+S4O62-,可由Na2S2O3标准溶液体积及浓度计算出I2,再根据反应IO3-+5I-+6H+===3I2+3H2O,计算出IO3-,进一步可计算该精制盐的碘元素的含量。
(1)两种方法要制得等质量的KIO3,根据电子守恒,KClO3和H2O2得电子数应相等,而每份KClO3和H2O2得电子数分别为5和2,所以KClO3和H2O2的物质的量之比为2:5;
答案为:2∶5;
(2)①步骤2中发生反应:IO3-+5I-+6H+===3I2+3H2O, 步骤3用Na2S2O3标准溶液滴定生成的I2,反应完时,I2消失,滴入的淀粉溶液蓝色退去。所以步骤3中滴定终点的现象是:溶液蓝色恰好褪去,且半分钟内不变色;
答案为:溶液蓝色恰好褪去,且半分钟内不变色;
②如果某操作引起代入计算的Na2S2O3标准溶液体积偏大,则造成I2测定结果偏大,从而造成食用精制盐中碘元素含量偏大;
A.装Na2S2O3标准溶液的滴定管水洗后未用Na2S2O3标准溶液润洗,会使Na2S2O3标准溶液稀释,引起滴定所用的Na2S2O3标准溶液体积偏大,造成测定结果偏大,A选项符合题意;
B.装Na2S2O3标准溶液的滴定管滴定前有气泡,滴定终了无气泡,会造成代入计算的Na2S2O3标准溶液体积偏小大,测定结果偏大,B选项符合题意;
C.滴定时未充分振荡,溶液局部变色就终止,反应不充分,滴入的Na2S2O3标准溶液偏小,造成测定结果偏小,C选项不符合题意;
D.若其他读数正确,滴定结束读数时俯视,会造成读数偏小,滴定前后的读数差偏小,代入计算的Na2S2O3标准溶液体积偏小,测定结果偏小,D选项不符合题意;
答案为:AB;
③根据反应I2+2S2O32-=2I-+S4O62-,可由Na2S2O3标准溶液体积及浓度计算出I2,再根据反应IO3-+5I-+6H+===3I2+3H2O,计算出IO3-,进一步可计算该精制盐的碘元素的含量。过程如下:n(Na2S2O3)= 1.0×10-3mol·L-1×12.00×10-3L=12.0×10-6mol;由关系式可知:I2~2Na2S2O3,n(I2)=6.0×10-6mol;根据方程式:IO3-+5I-+6H+=3I2+3H2O可知n(IO3-)= 2.0×10-6mol;20.00 g食盐中碘元素的物质的量n(I) =2.0×10-6mol×4=8.0×10-6mol,20.00g食盐中碘元素的质量m(I) =8.0×10-6mol×127 g·mol-1=1.016×10-3g,碘元素的含量=![]() =40.64 mg·kg-1;
=40.64 mg·kg-1;
故答案为:n(Na2S2O3)= 1.0×10-3mol·L-1×12.00×10-3L=12.0×10-6mol;由关系式可知:I2~2Na2S2O3,n(I2)=6.0×10-6mol;根据方程式:IO3-+5I-+6H+=3I2+3H2O,n(IO3-)= 2.0×10-6mol;20.00g食盐中碘元素的物质的量n(I) =2.0×10-6mol×4=8.0×10-6mol,20.00 g食盐中碘元素的质量m(I) =8.0×10-6mol×127 g·mol-1=1.016×10-3g,碘元素的含量=![]() =40.64 mg·kg-1。
=40.64 mg·kg-1。


科目:高中化学 来源: 题型:
【题目】氮、磷、砷(As)、锑(Sb)、铋(Bi)、镆(Mc)为元素周期表中原子序数依次增大的同族元素。
(1)砷(As)在元素周期表中的位置为____________________,磷的基态原子的价电子排布式为__________,六种元素中电负性最大的是__________(填元素符号)。
(2)N2分子中σ键和π键的数目比N(σ): N(π)=__________。NH3的分子构型为__________,中心原子的杂化方式为__________。
(3)热稳定性:NH3_____PH3(填“>”或“<”),沸点:N2H4______P2H4(填“>”或“<”)。
(4)已知:P(s,白磷)=P(s,黑磷)ΔH=-39.3kJ·mol-1;P(s,白磷)=P(s,红磷)ΔH=-17.6kJ·mol-1
由此推知,其中最稳定的磷单质是__________。
(5)SbCl3能发生较强烈的水解,生成难溶的SbOCl,因此配制SbCl3溶液应加入__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知亚磷酸(H3PO3)是具有强还原性的弱酸,可以被银离子氧化为磷酸。1摩尔亚磷酸最多消耗2摩尔氢氧化钠。
(1)已知亚磷酸可由PCl3水解而成,请写出相应的离子方程式__________。
(2)Na2HPO3是____(填“正盐”或“酸式盐”) 。
(3)亚磷酸与银离子反应时氧化剂与还原剂的物质的量之比为______________。
(4)某温度下,0.10 molL-1的H3PO3溶液的pH为1.6,即c(H+)=2.5×10-2 molL-1,该温度下H3PO3的电离平衡常数K1=___________________;(结果保留两位有效数字)。
(5)向H3PO3溶液中滴加NaOH溶液至中性,所得溶液中:c(Na+)_____c(H2PO3-)+2c(HPO32-)(填“>”、“<”或“=”,下同);在NaH2PO3溶液中,c(H+)+c(H3PO3)_____c(HPO32-)+c(OH-)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列各实验装置进行相应的实验,能达到实验目的的是
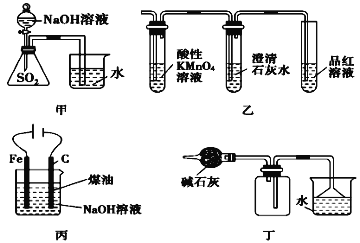
A. 用图甲装置证明SO2与NaOH溶液发生了反应
B. 用图乙装置检验某混合气体是否由SO2和CO2混合而成
C. 用图丙装置制备Fe(OH)2并能较长时间观察其颜色
D. 用图丁装置干燥、收集氯化氢,并吸收多余的氯化氢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,有c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1的一组醋酸、醋酸钠混合溶液,溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如下图所示。下列溶液中离子浓度关系正确的是
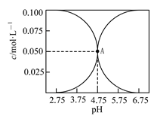
A.c(Na+)=0.1 mol·L-1的溶液中: c(H+)+c(CH3COOH)=c(OH-)
B.点A溶液中:c(Na+)>c(CH3COOH)
C.pH=3.5的溶液中:c(Na+)>c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
D.c(CH3COO-)=0.025 mol·L-1的溶液中:3c(Na+)<c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是( )
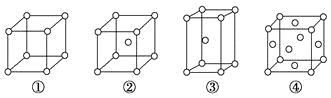
A. ①为简单立方堆积 ②为六方最密堆积 ③为体心立方堆积 ④为面心立方最密堆积
B. 每个晶胞含有的原子数分别为:①1个,②2个,③2个,④4个
C. 晶胞中原子的配位数分别为:①6,②8,③8,④12
D. 空间利用率的大小关系为:①<②<③<④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛(![]() )在Ni催化作用下加氢可得甲醇(CH3OH),以下说法中正确的是
)在Ni催化作用下加氢可得甲醇(CH3OH),以下说法中正确的是
A. 甲醛分子间可以形成氢键B. 甲醛分子和甲醇分子内C原子均采取sp2杂化。
C. 甲醛为极性分子D. 甲醇的沸点远低于甲醛的沸点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒容密闭容器中进行的可逆反应2NO2![]() 2NO +O2,可作为达到平衡状态的标志是( )
2NO +O2,可作为达到平衡状态的标志是( )
①单位时间内生成amo1O2的同时生成2amolNO2 ;
②单位时间内生成amolO2的同时生成2amolNO;
③混合气体的颜色不再改变;
④混合气体的密度不再改变的状态;
⑤混合气体的平均相对分子质量不再改变的状态;
⑥容器内的压强不再改变。
A.①②③④⑤B.②④⑤⑥C.①③④⑥D.①③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Ag++ SCN- = AgSCN↓(白色),某同学探究AgSCN的溶解平衡及转化,进行以下实验。

下列说法中,不正确的是
A. ①中现象能说明Ag+与SCN-生成AgSCN沉淀的反应有限度
B. ②中现象产生的原因是发生了反应Fe(SCN)3 + 3Ag+ = 3AgSCN↓+ Fe3+
C. ③中产生黄色沉淀的现象能证明AgI的溶解度比AgSCN的溶解度小
D. ④中黄色沉淀溶解的原因可能是AgI与KI溶液中的I-进一步发生了反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com