
【题目】在四种不同条件下测得反应2SO2+O2![]() 2SO3的反应速率如下表所示:
2SO3的反应速率如下表所示:
编号 | (1) | (2) | (3) | (4) |
反应速率[mol/(L·min)] | v(SO2) | v(O2) | v(SO3) | v(O2) |
0.4 | 0.25 | 0.5 | 0.3 |
其中反应速率最快的是( )
A.(1) B.(2) C.(3) D.(4)
 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】已知硫﹣氨热化学循环分解水的示意图如图1: 
(1)从反应物和生成物的角度来看反应I属于(填序号). a.离子反应 b.化合反应 c.中和反应 d.氧化还原反应
(2)反应II是将太阳能转化为电能,再进行电解,电解池阳极的反应式是 .
(3)反应IV是由(a)、(b)两步反应组成: H2SO4(l)═SO3(g)+H2O(g)△H=+177kJmol﹣1 (a)
2SO3(g)2SO2(g)+O2(g)△H=+196kJmol﹣1 (b)
H2O(l)═H2O(g)△H=+44kJmol﹣1 (c)
H2SO4(l)分解为SO2(g)、O2(g)及H2O(l)的热化学方程式为: .
提高H2SO4(l)的分解率的方法是(写两种) .
(4)恒温恒容的密闭容器中进行不同温度下的SO3分解实验[原理按反应(b)].SO3起始物质的量均为dmol,图2中L曲线为SO3的平衡转化率与温度的关系,M曲线表示不同温度下反应经过相同反应时间且未达到化学平衡时SO3的转化率. ①Y点对应温度下的反应速率:v(正)v(逆)(选填:>,<,=);随温度的升高,M曲线逼近L曲线的原因是:
②若X点时总压为0.1MPa,列式计算SO3分解反应在图中X点的平衡常数Kp=(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,保留2位有效数字).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应A(g)+2B(g)=C(g)+D(g)已达到平衡状态
①混合气体的压强②混合气体的密度③B的物质的量浓度④混合气体总物质的量⑤混合气体的平均相对分子质量⑥v(C)与v(D)的比值⑦混合气体总质量⑧混合气体总体积
A. ①②③④⑤⑥⑦⑧ B. ①③④⑤ C. ①②③④⑤⑦ D. ①③④⑤⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用中和滴定法去测定某烧碱的纯度,实验过程如下:
(i)配制待测液称取得 5.0g 固体烧碱样品(杂质不与酸反应)配制成 250mL 溶液,
(ii)用 0.2000molL﹣1 标准盐酸滴定待测烧碱溶液,实验操作如下 A.用碱式滴定管取上述烧碱溶液10.00mL,注入锥形瓶中,加入指示剂.B.用待测定 的溶液润洗碱式滴定管.C.用蒸馏水洗干净滴定管.D.取下酸式滴定管用标准的盐酸 溶液润洗后,将标准液注入酸式滴定管刻度“0”以上2~3cm处,再把酸式滴定管固定好,调节液面至刻度“0”或“0”刻度以下.E.检查滴定管是否漏水.F.另取锥形瓶,再重复 操作一次.G.把锥形瓶放在滴定管下面,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面的刻度.
(1)①滴定操作的正确顺序是(用序号填写): .
②该滴定操作中应选用的指示剂是: .
③在G操作中如何确定终点?
(2)数据处理
实验次数编号 | 盐酸溶液体积V(mL) | 氢氧化钠溶液体积 V(mL) |
1 | 22.4 | 10.00 |
2 | 22.60 | 10.00 |
3 | 26.00 | 10.00 |
4 | 22.50 | 10.00 |
根据上述各数据,选取合适的三组,计算待测烧碱溶液的浓度为 , 烧碱 的纯度为
(3)下列操作,会导致实验结果偏低的是(填序号).
①碱式滴管用蒸馏水洗净后没有用待测液润洗 ②锥形瓶用蒸馏水洗净后没有用待测液润洗 ③终点读数时俯视(滴定前读数准确) ④酸式滴定管尖端气泡没有排除,滴定后消失 ⑤振荡时锥形瓶中液滴飞溅出来 ⑥酸式滴定管用蒸馏水洗净后没有用标准液润洗.
查看答案和解析>>
科目:高中化学 来源: 题型:
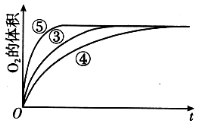
【题目】某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响,在常温下按照如下方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10 mL 2% H2O2溶液 | 无 |
② | 10 mL 5% H2O2溶液 | 无 |
③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol L-1 FeCl3溶液 |
④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol L-1 FeCl3溶液 |
⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol L-1 FeCl3溶液 |
(1)催化剂能加快化学反应速率的原因是__________________________。
(2)实验①和②的目的是_____________________。实验时由于较长时间没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是_____________________。
(3)写出实验③的化学反应方程式:______________。
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图。分析如图能够得出的实验结论是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中错误的是
A. 用规格为10mL的量筒量取6.2mL的液体
B. 用药匙或者纸槽把粉末状药品送入试管的底部
C. 过滤时玻璃棒的末端应轻轻靠在三层的滤纸上
D. 如果没有试管夹,可以临时手持试管给固体或液体加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合溶液中所含离子的浓度如表,则M离可能为( )
所含离子 | NO3﹣ | SO42﹣ | H+ | M |
浓度/(molL﹣1) | 2 | 1 | 2 | 1 |
A.Cl﹣
B.Ba2+
C.Na+
D.Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】淀粉溶液是一种胶体,并且淀粉遇到碘单质,可以出现明显的蓝色特征。现将淀粉和稀Na2SO4溶液混合,装在半透膜中,浸泡在盛蒸馏水的烧杯内,过一段时间后,取烧杯中液体进行实验,能证明半透膜完好无损的是
A. 加入BaCl2溶液产生白色沉淀 B. 加入碘水不变蓝
C. 加入BaCl溶液没有白色沉淀产生 D. 加入碘水变蓝
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com