
【题目】已知硫﹣氨热化学循环分解水的示意图如图1: 
(1)从反应物和生成物的角度来看反应I属于(填序号). a.离子反应 b.化合反应 c.中和反应 d.氧化还原反应
(2)反应II是将太阳能转化为电能,再进行电解,电解池阳极的反应式是 .
(3)反应IV是由(a)、(b)两步反应组成: H2SO4(l)═SO3(g)+H2O(g)△H=+177kJmol﹣1 (a)
2SO3(g)2SO2(g)+O2(g)△H=+196kJmol﹣1 (b)
H2O(l)═H2O(g)△H=+44kJmol﹣1 (c)
H2SO4(l)分解为SO2(g)、O2(g)及H2O(l)的热化学方程式为: .
提高H2SO4(l)的分解率的方法是(写两种) .
(4)恒温恒容的密闭容器中进行不同温度下的SO3分解实验[原理按反应(b)].SO3起始物质的量均为dmol,图2中L曲线为SO3的平衡转化率与温度的关系,M曲线表示不同温度下反应经过相同反应时间且未达到化学平衡时SO3的转化率. ①Y点对应温度下的反应速率:v(正)v(逆)(选填:>,<,=);随温度的升高,M曲线逼近L曲线的原因是:
②若X点时总压为0.1MPa,列式计算SO3分解反应在图中X点的平衡常数Kp=(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,保留2位有效数字).
【答案】
(1)ab
(2)SO32﹣﹣2e﹣+H2O=SO42﹣+2H+
(3)2H2SO4(l)?2SO2(g)+O2(g)+2H2O(l)△H=+462kJ?mol﹣1;升高温度和及时分离SO2或O2
(4)>;温度升高,反应速率加快,达到平衡所需的时间缩短(或温度升高,反应速率加快,相同时间内更快达到平衡);0.052MPa
【解析】解:(1)反应1是二氧化硫和氨气在水中反应生成亚硫酸铵的反应,反应的离子方程式为SO2+H2O+2NH3=2NH4++SO32﹣ , 属于离子反应和化合反应, 所以答案是:ab;(2)反应Ⅱ是太阳能转化为电能,电解亚硫酸铵生成硫酸铵和氢气,阳极上是亚硫酸根离子得到电子生成硫酸根离子,电极反应为:SO32﹣﹣2e﹣+H2O=SO42﹣+2H+ ,
所以答案是;SO32﹣﹣2e﹣+H2O=SO42﹣+2H+;(3)已知H2SO4(l)=SO3(g)+H2O(g)△H=+177kJmol﹣1…(a)
2SO3(g)2SO2(g)+O2(g)△H=+196kJmol﹣1…(b)
H2O(l)═H2O(g)△H=+44kJmol﹣1 (c)
据盖斯定律,2a+b﹣2c得:2H2SO4(l)2SO2(g)+O2(g)+2H2O(l)△H=+462kJmol﹣1;
升高温度和及时分离SO2或O2都是提高H2SO4(l)的分解率方法,
所以答案是:2H2SO4(l)2SO2(g)+O2(g)+2H2O(l)△H=+462kJmol﹣1;升高温度和及时分离SO2或O2;(4)①Y点时反应还没有达到平衡状态,正向进行,所以正反应速率大于逆反应速率,温度的升高,曲线b向曲线a逼近,反应速率加快,达到平衡时的时间缩短,
所以答案是:>;温度升高,反应速率加快,达到平衡所需的时间缩短(或温度升高,反应速率加快,相同时间内更快达到平衡);(5)起始时充入dmol SO3反应体系起始总压强0.1MPa.反应在一定的温度下达到平衡时SO3的转化率为60%,转化的二氧化硫为dmol×0.6=0.6dmol,则:
2SO3(g) | 2SO2(g)+ | O2(g) | |
起始量(mol): | D | 0 | 0 |
变化量(mol): | 0.6d | 0.6d | 0.3d |
平衡量(mol): | 0.4d | 0.6d | 0.3d |
恒温恒容下,平衡时总压强为0.1MPa× ![]() =0.13MPa,
=0.13MPa,
故Kp= ![]() =
= 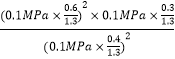 =0.052MPa,
=0.052MPa,
所以答案是:0.052MPa.
【考点精析】认真审题,首先需要了解化学平衡状态本质及特征(化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)),还要掌握化学平衡的计算(反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%)的相关知识才是答题的关键.


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:
【题目】如图所示,A是由导热材料制成的密闭容器,B是一耐化学腐蚀且易于传热的透明气囊.关闭K2 , 将各1mol NO2通过K1、K3分别充入A、B中,反应起始时A、B的体积相同均为a L. 
①B中可通过判断可逆反应2NO2N2O4已经达到平衡.
②若平衡后在A容器中再充入0.5mol N2O4 , 则重新到达平衡后,平衡混合气中NO2的体积分数(填“变大”“变小”或“不变”).
③若容器A中到达平衡所需时间t s,达到平衡后容器内压强为起始压强的0.8倍,则平均化学反应速率v(NO2)等于
④若打开K2 , 平衡后B容器的体积缩至0.4a L,则打开K2之前,气球B体积为L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列萃取与分液结合进行的操作(用CCl4为萃取剂从碘水中萃取碘)中错误的是
A.饱和碘水和CCl4加入分液漏斗中后,塞上上口部的塞子,用左手压住分液漏斗上口部,右手握住活塞部分,把分液漏斗倒转过来振荡
B.静置,分液漏斗中溶液分层,下层呈紫红色,上层几乎无色
C.打开分液漏斗的活塞,使全部下层液体沿承接液体的烧杯内壁慢慢流出
D.最后继续打开活塞用另一个烧杯承接上层液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同温度下,向2L密闭容器中加入1molNO和1mol活性炭,发生反应:2NO(g)+C(s)═N2(g)+CO2(g)△H=﹣213.5kJ mol﹣1 , 达到平衡时的数据如下:
温度/℃ | n(活性炭)/mol | n(CO2)/mol |
T1 | 0.70 | |
T2 | 0.25 |
下列说法不正确的是( )
A.上述信息可推知:T1<T2
B.T1℃时,该反应的平衡常数K= ![]()
C.T1℃时,若开始时反应物的用量均减小一半,平衡后NO的转化率减小
D.T2℃时,若反应达平衡后再缩小容器的体积,c(N2):c(NO)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应mA(g)+nB(g)![]() pC(g)在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表所示:
pC(g)在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表所示:
压强/Pa | 2×105 | 5×105 | 1×106 |
c(A)/(mol·L-1) | 0.08 | 0.20 | 0.44 |
分析表中数据,回答:
(1)当压强从2×105 Pa增加到5×105 Pa时,平衡 (填“向左”“向右”或“不”)移动,理由是 。
(2)当压强从5×105 Pa增加到1×106 Pa时,该反应的化学平衡 移动,判断的依据是 ,可能的原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前市场上有一种专门为婴幼儿设计的电解质饮料,适合在婴幼儿感冒、发烧时快速补充体内流失的电解质成分。下列物质可用作该饮料中的电解质的是
A.Fe B.葡萄糖 C.MgSO4 D.CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述正确的是
A.标准状况下,22.4 L空气含有NA个单质分子
B.常温常压下,0.1 mol Na2CO3含有的Na+数目为0.2NA
C.标准状况下,22.4 L H2O含有的分子数为 NA
D.物质的量浓度为0.5 mol·L1的MgCl2溶液中,含有Cl个数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】689 K时,在1 L密闭容器中进行的反应:H2(g)+I2(g)![]() 2HI(g)达到平衡,图甲表示当起始物为1 mol·L-1 H2和1 mol·L-1 I2时,容器内各物质的浓度c的变化与时间t的关系示意图。
2HI(g)达到平衡,图甲表示当起始物为1 mol·L-1 H2和1 mol·L-1 I2时,容器内各物质的浓度c的变化与时间t的关系示意图。

(1)请在图乙中画出当起始物为2 mol·L-1 HI时,容器中各物质的浓度变化与时间的关系示意图。
(2)由图中的事实说明化学平衡具有的特征是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在四种不同条件下测得反应2SO2+O2![]() 2SO3的反应速率如下表所示:
2SO3的反应速率如下表所示:
编号 | (1) | (2) | (3) | (4) |
反应速率[mol/(L·min)] | v(SO2) | v(O2) | v(SO3) | v(O2) |
0.4 | 0.25 | 0.5 | 0.3 |
其中反应速率最快的是( )
A.(1) B.(2) C.(3) D.(4)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com