
����Ŀ��������ȡ���Һ��Ͻ��еIJ�������CCl4Ϊ��ȡ���ӵ�ˮ����ȡ�⣩�д������
A�����͵�ˮ��CCl4�����Һ©���к������Ͽڲ������ӣ�������ѹס��Һ©���Ͽڲ���������ס�������֣��ѷ�Һ©����ת������
B�����ã���Һ©������Һ�ֲ㣬�²���Ϻ�ɫ���ϲ㼸����ɫ
C����Һ©���Ļ�����ʹȫ���²�Һ���سн�Һ����ձ��ڱ���������
D����������������һ���ձ��н��ϲ�Һ��
 ����ѵ�����⿼ϵ�д�
����ѵ�����⿼ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2015���������������Ű�ҹ��ж������������У�����β����ȼúβ������ɿ�����Ⱦ��ԭ��֮һ��
��1������β����������Ҫԭ��Ϊ��2NO��g��+2CO ��g�� ![]() 2CO2 ��g��+N2 ��g�����ܱ������з����÷�Ӧʱ��c��CO2�����¶ȣ�T���������ı������S����ʱ�䣨t���ı仯���ߣ���ͼ1��ʾ��
2CO2 ��g��+N2 ��g�����ܱ������з����÷�Ӧʱ��c��CO2�����¶ȣ�T���������ı������S����ʱ�䣨t���ı仯���ߣ���ͼ1��ʾ�� 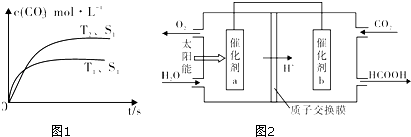
�ݴ��жϣ�
�ٸ÷�Ӧ��ƽ�ⳣ������ʽΪ ��
�ڸ÷�Ӧ�ġ�H0��ѡ�����������������
�۵��������������һ��ʱ�����������������ѧ��Ӧ���ʣ��������ı����S1��S2 �� ����ͼ�л���c��CO2����T2��S2�����´ﵽƽ������еı仯���ߣ�
��2��ֱ���ŷ�úȼ�ղ������������������صĻ������⣮
��úȼ�ղ����������������������CH4����ԭNOx�������������������Ⱦ��
CH4��g��+2NO2��g��=N2��g��+CO2��g��+2H2O��g����H=��867kJmol��1
2NO2��g��N2O4��g����H=��56.9kJmol��1
д��CH4����ԭN2O4��g������N2��g����CO2��g����H2O��g�����Ȼ�ѧ����ʽ ��
�ڽ�ȼú�����Ķ�����̼�������ã��ɴﵽ��̼�ŷŵ�Ŀ�ģ�ͼ2��ͨ�����ת��ԭ��������ԭ���Ʊ��²�Ʒ��ʾ��ͼ��д���������ת�����̵Ļ�ѧ��Ӧ����ʽ �� ����a��b֮�����ӵ����ϵ�����������������a��b��b��a����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ���ס����ǵ绯ѧʵ��װ�ã���ش��������⣺ 
��1�����ס��������ձ��о�ʢ�ű���NaCl��Һ��
�ټ���ʯī���ϵĵ缫��Ӧʽ�� ��
�ڽ�ʪ��ĵ���KI��ֽ�������ձ����Ϸ���������ֽ�ȱ�������ɫ��������Ϊ������ɵ�ij������A������I��������I2 �� ��A�����I2�����ʵ���֮��Ϊ5��1��Ӧ�������������ᣬ�÷�Ӧ�Ļ�ѧ����ʽΪ ��
���������������������ձ�����Һ֮��ķ�Ӧ�����ҷ�Ӧ��0.01mol����ת�ƺ�ֹͣʵ�飬�ձ�����Һ�����Ϊ100mL������Һ���Ⱥ��pH=
��2�����ס������ձ��о�ʢ��CuSO4��Һ��
�ټ��������ϵĵ缫��ӦʽΪ ��
�������ܷ�Ӧ�����ӷ���ʽΪ ��
�������ʼʱ����ʢ��100mL pH=5��CuSO4��Һ��25�棩��һ��ʱ�����Һ��pH��Ϊ1����Ҫʹ��Һ�ָ�����ʼʱ��Ũ�ȣ�������Һ����ı仯����������Һ�м�������д���ʵĻ�ѧʽ��g��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й����ʽṹ��������ȷ����
A.�����ӻ������в����ܴ��ڷǼ��Թ��ۼ�
B.�ɵ��Ӷ����ƶ������������һ���ǽ�������
C.�м��ܴܺ�Ĺ��ۼ����ڵ������۷е�һ���ܸ�
D.ֻ���й��ۼ������ʲ�һ���ǹ��ۻ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£���Fe��OH��3��s����Cu��OH��2��s���ֱ���������ˮ�дﵽ�����ܽ�ƽ�����������Ũ������ҺpH�ı仯��ͼ��ʾ�������ж���ȷ���ǣ� �� 
A.���¶��£�Ksp[Fe��OH��3]��Ksp[Cu��OH��2]
B.c��d �����������Һ��c��H+�� ��c��OH���� �˻������
C.Cu��OH��2��c�����d���������Һ���ܽ�̶�С
D.������ŨNH3H2O��ʹ��Һ��a��䵽b��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и����е����ӣ�������Һ�д����������
A.H+��K+��SO42-��OH-B.H+��K+��S2-��CO32-
C.K+��NH4+��Cl-��SO42-D.Na+��Ca2+��CO32-��NO3-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���Ȼ�ѧѭ���ֽ�ˮ��ʾ��ͼ��ͼ1�� 
��1���ӷ�Ӧ���������ĽǶ�������ӦI����������ţ��� a�����ӷ�Ӧ b�����Ϸ�Ӧ c���кͷ�Ӧ d��������ԭ��Ӧ
��2����ӦII�ǽ�̫����ת��Ϊ���ܣ��ٽ��е�⣬���������ķ�Ӧʽ�� ��
��3����ӦIV���ɣ�a������b��������Ӧ��ɣ� H2SO4��l���TSO3��g��+H2O��g����H=+177kJmol��1 ��a��
2SO3��g��2SO2��g��+O2��g����H=+196kJmol��1 ��b��
H2O��l���TH2O��g����H=+44kJmol��1 ��c��
H2SO4��l���ֽ�ΪSO2��g����O2��g����H2O��l�����Ȼ�ѧ����ʽΪ�� ��
���H2SO4��l���ķֽ��ʵķ����ǣ�д���֣� ��
��4�����º��ݵ��ܱ������н��в�ͬ�¶��µ�SO3�ֽ�ʵ��[ԭ������Ӧ��b��]��SO3��ʼ���ʵ�����Ϊdmol��ͼ2��L����ΪSO3��ƽ��ת�������¶ȵĹ�ϵ��M���߱�ʾ��ͬ�¶��·�Ӧ������ͬ��Ӧʱ����δ�ﵽ��ѧƽ��ʱSO3��ת���ʣ� ��Y���Ӧ�¶��µķ�Ӧ���ʣ�v������v���棩��ѡ���������=�������¶ȵ����ߣ�M���߱ƽ�L���ߵ�ԭ���ǣ�
����X��ʱ��ѹΪ0.1MPa����ʽ����SO3�ֽⷴӦ��ͼ��X���ƽ�ⳣ��Kp=����ƽ���ѹ����ƽ��Ũ�ȼ��㣬��ѹ=��ѹ�����ʵ�������������2λ��Ч���֣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��µĶ��������У���������Щ���������ٷ����仯ʱ��������ӦA��g��+2B��g��=C��g��+D��g���Ѵﵽƽ��״̬
�ٻ�������ѹǿ�ڻ��������ܶ���B�����ʵ���Ũ���ܻ�����������ʵ����ݻ�������ƽ����Է���������v��C����v��D���ı�ֵ��������������������������
A. �٢ڢۢܢݢޢߢ� B. �٢ۢܢ� C. �٢ڢۢܢݢ� D. �٢ۢܢݢ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com