
【题目】反应mA(g)+nB(g)![]() pC(g)在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表所示:
pC(g)在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表所示:
压强/Pa | 2×105 | 5×105 | 1×106 |
c(A)/(mol·L-1) | 0.08 | 0.20 | 0.44 |
分析表中数据,回答:
(1)当压强从2×105 Pa增加到5×105 Pa时,平衡 (填“向左”“向右”或“不”)移动,理由是 。
(2)当压强从5×105 Pa增加到1×106 Pa时,该反应的化学平衡 移动,判断的依据是 ,可能的原因是 。
 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:
【题目】A、B、C三种物质各15g,它们发生反应时,只生成30g新物质D。若增加10gC时,A与C恰好完全反应,则A与B参加反应质量之比为
A.1:1 B.2:1 C.2:3 D.3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质结构的叙述正确的是
A.在离子化合物中不可能存在非极性共价键
B.由电子定向移动而导电的物质一定是金属晶体
C.有键能很大的共价键存在的物质熔沸点一定很高
D.只含有共价键的物质不一定是共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的离子,能在溶液中大量共存的是
A.H+、K+、SO42-、OH-B.H+、K+、S2-、CO32-
C.K+、NH4+、Cl-、SO42-D.Na+、Ca2+、CO32-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组可用同种方法除去杂质(括号内物质)的是
A.植物油(水)与 乙醇(水)
B.蛋白质溶液(NaCl)与淀粉溶液(KI)
C.泥水(淀粉溶液)与 Fe(OH)3胶体(FeCl3)
D.氧化钙(碳酸钙)与 NaHCO3(Na2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知硫﹣氨热化学循环分解水的示意图如图1: 
(1)从反应物和生成物的角度来看反应I属于(填序号). a.离子反应 b.化合反应 c.中和反应 d.氧化还原反应
(2)反应II是将太阳能转化为电能,再进行电解,电解池阳极的反应式是 .
(3)反应IV是由(a)、(b)两步反应组成: H2SO4(l)═SO3(g)+H2O(g)△H=+177kJmol﹣1 (a)
2SO3(g)2SO2(g)+O2(g)△H=+196kJmol﹣1 (b)
H2O(l)═H2O(g)△H=+44kJmol﹣1 (c)
H2SO4(l)分解为SO2(g)、O2(g)及H2O(l)的热化学方程式为: .
提高H2SO4(l)的分解率的方法是(写两种) .
(4)恒温恒容的密闭容器中进行不同温度下的SO3分解实验[原理按反应(b)].SO3起始物质的量均为dmol,图2中L曲线为SO3的平衡转化率与温度的关系,M曲线表示不同温度下反应经过相同反应时间且未达到化学平衡时SO3的转化率. ①Y点对应温度下的反应速率:v(正)v(逆)(选填:>,<,=);随温度的升高,M曲线逼近L曲线的原因是:
②若X点时总压为0.1MPa,列式计算SO3分解反应在图中X点的平衡常数Kp=(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,保留2位有效数字).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关氢氧化铁胶体说法正确的是
A. 将外加直流电源通过该胶体,阴极处颜色变深,则说明该胶体带正电荷
B. 鉴别FeCl3溶液和Fe(OH)3胶体,可用丁达尔效应或观察颜色两种方法
C. 采用过滤,可将Fe(OH)3胶体中的FeCl3杂质除去
D. 向Fe(OH)3胶体中加入大量盐酸,则可引起胶体聚沉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇(沸点:64.7oC)是一种清洁能源,制取甲醇的成熟的方法有很多,利用CO2和H2甲醇制甲醇的反应方程式如下:
CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=﹣49.4kJ/mol
Ⅰ.一定条件下,向容积为2L恒容密闭容器中充入1.2mol CO2(g)和2.8mol H2(g),在不同温度下达平衡时,CH3OH的体积分数变化曲线如图1所示.
(1)保持T1恒温下,从开始到平衡所需时间为10分钟.测定平衡时容器内压强为P1MPa.
①开始到平衡的平均反应速率v(CO2)=mol/(Lmin)
②该温度下反应的平衡常数K=
(2)使上述反应在T2(T1<T2)的恒温下进行并达平衡.测定到平衡所需是为t2分钟,平衡时容器内压强为P2 MPa.则t210;P2P1(填>、<或=)
Ⅱ.某研究小组通过实验探究不同的氢碳比[n(H2)/n(CO2)]对反应物转化率的影响.
向容积为2L的恒温恒容密闭容器,把总物质的量为4mol的H2 (g)和CO2 (g)以不同的氢碳比[n(H2)/n(CO2)]开始进行反应,分别达到平衡时,测定剩余CH3OH的浓度以计算CO2(g)或H2(g)的转化率.
(3)图2画出了CO2(g)转化率的变化曲线,请在图中画出H2(g)的转化率的变化曲线(以A为起点),并作相应的标注 .
Ⅲ.利用利用CO2和H2也可以制取另一种重要的有机溶剂甲醚CH3OCH3 .
已知2CH3OH(g)=CH3OCH3(g)+H2O(g)△H=﹣25.kJ/mol写出利用CO2和H2制取甲醚的热化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
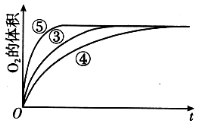
【题目】某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响,在常温下按照如下方案完成实验。
实验编号 | 反应物 | 催化剂 |
① | 10 mL 2% H2O2溶液 | 无 |
② | 10 mL 5% H2O2溶液 | 无 |
③ | 10 mL 5% H2O2溶液 | 1 mL 0.1 mol L-1 FeCl3溶液 |
④ | 10 mL 5% H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol L-1 FeCl3溶液 |
⑤ | 10 mL 5% H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol L-1 FeCl3溶液 |
(1)催化剂能加快化学反应速率的原因是__________________________。
(2)实验①和②的目的是_____________________。实验时由于较长时间没有观察到明显现象而无法得出结论。资料显示,通常条件下H2O2稳定,不易分解。为了达到实验目的,你对原实验方案的改进是_____________________。
(3)写出实验③的化学反应方程式:______________。
(4)实验③、④、⑤中,测得生成氧气的体积随时间变化的关系如图。分析如图能够得出的实验结论是____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com