
����Ŀ��ijѧУ��ѧѧϰС��Ϊ̽���������������ʣ�����ͼ��ʾװ�ý���ʵ�顣

��ش��������⣺
��1��װ�ü���ʢ��Ũ���������A��������__________����װ���з�����Ӧ�Ļ�ѧ����ʽΪ_________________________��
��2��ʵ������У�װ���ҡ����г��ֵ�����ֱ��ǣ�____________________��____________________��װ�ñ��е��Թ��ڷ�����Ӧ�����ӷ���ʽΪ��_____________________��
��3��ȡ��װ�ñ��е��Թ�D�������еμ�FeSO4��Һ����Һ��Ϊ__________ɫ��Ϊ��֤����Ԫ���ڸ÷�Ӧ�еIJ������____________________________________________________________��
���𰸡� ��Һ©�� Cu+4HNO3(Ũ)=Cu(NO3)2+2NO2��+2H2O ���ɺ���ɫ���� ����ˮ������ɫ���ݣ����Ϸ���Ϊ����ɫ 3NO2+H2O=2H++![]() +NO �� ȡ����������Һ���Թ��У�����KSCN��Һ������ΪѪ��ɫ����֤������Fe3+
+NO �� ȡ����������Һ���Թ��У�����KSCN��Һ������ΪѪ��ɫ����֤������Fe3+
����������1��װ�ü���ʢ��Ũ���������A�������Ƿ�Һ©������ƿ�з���Ũ������ͭƬ��������ԭ��Ӧ����ѧ����ʽΪ��Cu+4HNO3��Ũ���TCu��NO3��2+2NO2��+2H2O���ʴ�Ϊ����Һ©����Cu+4HNO3��Ũ���TCu��NO3��2+2NO2��+2H2O��
��2��ͭ��Ũ������װ�ü��з�ӦCu+4HNO3��Ũ���TCu��NO3��2+2NO2��+2H2O�����ɺ���ɫ�Ķ����������������װ�ã�����װ�����г��ֵ�����Ϊ���ɺ���ɫ���壻�������������ܽ����װ�ú�ˮ��Ӧ3NO2+H2O�T2H++2NO3-+NO�����ɵ�һ��������Һ���Ϸ��Ŀ�����Ӧ���ɺ���ɫ�Ķ�������������װ�ñ��г��ֵ�����Ϊ����ˮ������ɫ���ݣ����Ϸ���Ϊ����ɫ���ʴ�Ϊ�����ɺ���ɫ���壻����ˮ������ɫ���ݣ����Ϸ���Ϊ����ɫ��3NO2+H2O�T2H++2NO3-+NO��
��3����װ���е�Һ��Ϊ����������ˮ��Ӧ���ɵ����ᣬ������������ԣ������������л�ԭ�ԣ����߷���������ԭ��Ӧ4H++NO3-+3Fe2+=NO+H2O+3Fe3+�������Ӻ���������ӷ�ӦFe3++3SCNFe��SCN��3����Ѫ��ɫ��������֤�������������ӵ����ɣ����Ҫ֤����Ԫ���ڸ÷�Ӧ�еIJ����������Һ�еμ�KSCN��Һ������Һ�Ƿ��ΪѪ��ɫ���ʴ�Ϊ������ȡ����������Һ���Թ��У�����KSCN��Һ������ΪѪ��ɫ����֤������Fe3+��


 �Ƹ������������ϵ�д�
�Ƹ������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�˳��Ӧ����Դ���ù�ҵ�ϼ�Һ��Ca��OH��2��NaOH�����̵��������ճɷ�SO2������ȡʯ����CaSO42H2O��������������Na2S2O8������Ƽ�Ҫ������ͼ��
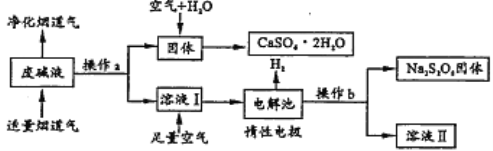
��1���̵�����SO2��ϼ����ɳ����Ļ�ѧ����ʽΪ_____������a��������_____��
��2������CaSO42H2O������û���漰���Ļ�ѧ��Ӧ����Ϊ_____������ţ���
A.���ֽⷴӦ B.���Ϸ�Ӧ C.�ֽⷴӦ D.������Ӧ E.�û���Ӧ
��3����Һ��ͨ�����������Ӧ�Ļ�ѧ����ʽΪ_____��
��4���ö��Ե缫���ʱ����������Na2S2O8�ĵ缫��ӦΪ_____�������������п���ѭ�����õ�������H2O��_____���ѧʽ����
��5��һ�������½�S8��s����O2��g����NaOH��s��ת�������е�������ϵ����ͼ��ʾ����S8��s��ȼ�յ��Ȼ�ѧ��Ӧ����ʽΪ_____��

��6������ȡag Na2S2O8ʱ��������bL������������������������ɵ�H2����ڱ�״����Ϊ_____L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڹ���������ռ����Ҫ�ĵ�λ����ҵ�ϳɰ��ķ�ӦΪ��N2��g��+3H2��g��2NH3��g����H=��92.4KJ/mol����ش��������⣺
��1�������ϳɰ���Ӧ����ƽ��״̬����������ĸ��
a��2v����NH3����3v����H2��b��c��N2��=c��H2����c��NH3��
c����λʱ������3molH��H�����ѣ�ͬʱ��6molN��H������
d�����º���ʱ��������ѹǿ����
e�����º���ʱ�������ڻ��������ֲ�����
��2����һ�������µ��ܱ������У��÷�Ӧ�ﵽƽ�⣬��Ҫ�ӿ췴Ӧ���ʣ���Ҫ���H2��ת���ʣ����Բ�ȡ�Ĵ�ʩ��������ĸ��
a�������¶� b�������Һ̬���� c������N2Ũ�� d������H2Ũ��
��3����֪��400��ʱ��N2��g��+3H2��g��2NH3��g����ƽ�ⳣ��K=0.5����NH3��g��N2��g��+3H2��g����ƽ�ⳣ������ʽΪK= �� ��ֵΪ ��
��4���������ܱ�����A��B��A�������ֺ��ݣ�B����������ѹ����ʼʱ���ݻ���ȵ�A��B�зֱ�ͨ�������NH3���壬��������Ӧ��2NH3��g��3H2��g��+N2��g������
�ٴﵽƽ�������ʱ�䣺t��A��t��B����ƽ��ʱ��NH3��ת���ʣ�a��A��a��B�������������=����������
�ڴﵽƽ������������зֱ�ͨ������ĺ�����A��ƽ�����ƶ���B��ƽ�����ƶ������������Ӧ���������淴Ӧ��������������
��5����������ͬ�����и�����1molN2��3molH2 �� �ڲ�ͬ�����·�Ӧ���ﵽƽ�⣬�����������[����NH3��]��ʱ��仯��������ͼ��ʾ������˵������ȷ����������ĸ����ͬ���� 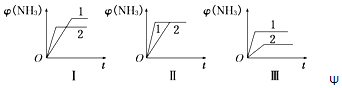
a��ͼ������Dz�ͬѹǿ�Է�Ӧ��Ӱ�죬��p2��p1
b��ͼ�������ͬ��ͬѹ�²�ͬ�����Է�Ӧ��Ӱ�죬�Ҵ�������1��2
c��ͼ������Dz�ͬ�¶ȶԷ�Ӧ��Ӱ�죬��T1��T2 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�����������˵����ȷ���ǣ� ��
A. 2.4g����þ���þ����ʱʧȥ�ĵ�����ĿΪ0.1NA
B. �����£�2g��������������ĿΪNA
C. ��25�棬![]() ʱ��11.2L����������ԭ����ĿΪNA
ʱ��11.2L����������ԭ����ĿΪNA
D. ��״����22.4L�����������ķ�����ΪNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(SeO2)��һ�����������䱻��ԭ��ĵ��������ܳ�Ϊ������Ⱦ�ͨ����ŨHNO3��ŨH2SO4��Ӧ����SeO2�Ի���Se�����������գ�
��1��Se��ŨHNO3��Ӧ�Ļ�ԭ����ΪNO��NO2����NO��NO2�����ʵ���֮��Ϊ1��1��д��Se��ŨHNO3��Ӧ�Ļ�ѧ����ʽ��_________________________________________��
��2����֪��Se��2H2SO4(Ũ)===2SO2����SeO2��2H2O��2SO2��SeO2��2H2O===Se��2SO![]() ��4H����SeO2��H2SO4(Ũ)��SO2����������ǿ������˳����________________________��
��4H����SeO2��H2SO4(Ũ)��SO2����������ǿ������˳����________________________��
��3�����յõ���SeO2�ĺ���������ͨ������ķ����ⶨ��
��____SeO2��____I����____H+===____Se��____I2��____H2O
��I2��2Na2S2O3===Na2S4O6��2NaI
��ƽ��ѧ����ʽ�٣����������ת�Ƶķ������Ŀ��_____________
��4��ʵ���У�ȷ����SeO2��Ʒ0.150 0 g��������0.200 0 mol��L��1��Na2S2O3��Һ25.00 mL��������Ʒ��SeO2����������Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ�����������������
A. 0.5mol/LCuCl2��Һ�к��е�Cl-��ĿΪNA
B. 42gC2H4��C4H8�Ļ�����к�����ԭ����Ϊ6NA
C. ��״����,H2��CO�������4.48L������O2�г��ȼ������O2������Ϊ0.1NA
D. �ڷ�Ӧ4Cl2+8NaOH=6NaCl+NaClO+NaClO3+4H2O�У�����1molCl2ʱת�Ƶĵ�������Ϊ1.5NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л���ṹ��ʽ��ͼ������˵��������ǣ� �� ![]()
A.���л������ڱ�������
B.���л���������ֵ�Ȳ���ֱ��������ӳɵõ�
C.������2��3���������黥Ϊͬϵ��
D.������һ��ȡ�����ﹲ��5��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ʵ�������������ȫȼ�գ��������������ǣ� ��
A.C6H6
B.C2H6
C.C3H6
D.CH4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ײ�����������ֱ��Ϊ1nm��100nm�IJ��ϣ�����̼�������е�һ�֡�ij�о���������̼���ȵķ�ɢ������ˮ�У��õ������ʣ�������Һ ���ǽ��� �����ж�������� ����������Ĥ ����������ֽ����ֹ�����ֺ�ɫ������������ȷ����
A. �٢ܢ� B. �ڢۢ� C. �ڢۢ� D. �٢ۢܢ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com