
����Ŀ�����ڹ���������ռ����Ҫ�ĵ�λ����ҵ�ϳɰ��ķ�ӦΪ��N2��g��+3H2��g��2NH3��g����H=��92.4KJ/mol����ش��������⣺
��1�������ϳɰ���Ӧ����ƽ��״̬����������ĸ��
a��2v����NH3����3v����H2��b��c��N2��=c��H2����c��NH3��
c����λʱ������3molH��H�����ѣ�ͬʱ��6molN��H������
d�����º���ʱ��������ѹǿ����
e�����º���ʱ�������ڻ��������ֲ�����
��2����һ�������µ��ܱ������У��÷�Ӧ�ﵽƽ�⣬��Ҫ�ӿ췴Ӧ���ʣ���Ҫ���H2��ת���ʣ����Բ�ȡ�Ĵ�ʩ��������ĸ��
a�������¶� b�������Һ̬���� c������N2Ũ�� d������H2Ũ��
��3����֪��400��ʱ��N2��g��+3H2��g��2NH3��g����ƽ�ⳣ��K=0.5����NH3��g��N2��g��+3H2��g����ƽ�ⳣ������ʽΪK= �� ��ֵΪ ��
��4���������ܱ�����A��B��A�������ֺ��ݣ�B����������ѹ����ʼʱ���ݻ���ȵ�A��B�зֱ�ͨ�������NH3���壬��������Ӧ��2NH3��g��3H2��g��+N2��g������
�ٴﵽƽ�������ʱ�䣺t��A��t��B����ƽ��ʱ��NH3��ת���ʣ�a��A��a��B�������������=����������
�ڴﵽƽ������������зֱ�ͨ������ĺ�����A��ƽ�����ƶ���B��ƽ�����ƶ������������Ӧ���������淴Ӧ��������������
��5����������ͬ�����и�����1molN2��3molH2 �� �ڲ�ͬ�����·�Ӧ���ﵽƽ�⣬�����������[����NH3��]��ʱ��仯��������ͼ��ʾ������˵������ȷ����������ĸ����ͬ���� 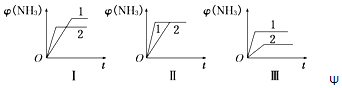
a��ͼ������Dz�ͬѹǿ�Է�Ӧ��Ӱ�죬��p2��p1
b��ͼ�������ͬ��ͬѹ�²�ͬ�����Է�Ӧ��Ӱ�죬�Ҵ�������1��2
c��ͼ������Dz�ͬ�¶ȶԷ�Ӧ��Ӱ�죬��T1��T2 ��
���𰸡�
��1��cd
��2��c
��3��![]() ��2
��2
��4��������������������Ӧ����
��5��b
���������⣺��1��a.2v����NH3����3v����H2�������淴Ӧ���ʲ��䣬���Բ����ܴ�ƽ��״̬���ʴ���b��c��N2��=c��H2����c��NH3����δ����������Ĺ�ϵ���ʴ���
c����λʱ������3molH��H�����ѵ�Ч��6molN��H���γɣ�ͬʱ��6molN��H�����ѣ����淴Ӧ������ȣ���Ӧ��ƽ��״̬������ȷ��
d�����º���ʱ��������ѹǿ���䣬˵����������ʵ������䣬��Ӧ��ƽ��״̬������ȷ��
e�����º���ʱ�������ڻ��������ֲ����䣬˵����Ӧδ��ƽ��״̬���ʴ���
��ѡ��cd����2��a�������¶ȣ���Ӧ���ʼӿ죬��ƽ�������ƶ���������ת���ʼ�С���ʴ���
b�������Һ̬��������Ӧ���ʼ�С��ƽ�������ƶ����ʴ���
c������N2Ũ�ȣ���Ӧ���ʼӿ죬ƽ�������ƶ���������ת����������ȷ��
d������H2Ũ�ȣ���Ӧ���ʼӿ죬��������ת���ʼ�С���ʴ���
��ѡ��c����3��N2��g��+3H2��g��2NH3��g����K��=0.5����2NH3��g��N2��g��+3H2��g����ƽ�ⳣ������ʽΪ��K= ![]() ��K=
��K= ![]() =2�����Դ��ǣ�
=2�����Դ��ǣ� ![]() ��2�� ��4����A�����ܱ��ֺ��ݣ���Ӧ��ѹǿ����B�����ܱ��ֺ�ѹ������A�е�ѹǿ����B��ѹǿԽ��Ӧ����Խ�죬����ʱ��Խ�̣�������ʱ��AС��B��ѹǿ����ƽ�����淴Ӧ�����ƶ�������ѹǿԽ��ת����ԽС��A��ѹǿ����A��ת����С��B�����Դ��ǣ���������
��2�� ��4����A�����ܱ��ֺ��ݣ���Ӧ��ѹǿ����B�����ܱ��ֺ�ѹ������A�е�ѹǿ����B��ѹǿԽ��Ӧ����Խ�죬����ʱ��Խ�̣�������ʱ��AС��B��ѹǿ����ƽ�����淴Ӧ�����ƶ�������ѹǿԽ��ת����ԽС��A��ѹǿ����A��ת����С��B�����Դ��ǣ���������
�ڴﵽƽ������������зֱ�ͨ������ĺ�����A������䣬B������ͣ���A�и���Ӧ���ʵ�Ũ�Ȳ��䣬A�з�Ӧ���ʲ��䣬B�и���Ӧ��Ũ�ȼ�С������Ӧ����ռ��ѹǿ��С��ƽ�����ƣ�
���Դ��ǣ�����������Ӧ���� ��5��a������ѹǿƽ�����ƣ������ĺ���Ӧ���ʴ���
b��������Ӱ��ƽ���ƶ�����ͼ���֪�������ܣ�1��2������ȷ��
c�������¶�ƽ�������ƶ��������ĺ�����С����c����
���Դ��ǣ�b��
�����㾫����������Ŀ����֪���������û�ѧƽ��״̬���ʼ������ͻ�ѧƽ��״̬���жϵ����֪ʶ���Եõ�����Ĵ𰸣���Ҫ���ջ�ѧƽ��״̬�����������ȡ��� V��=V��>0�����������Ƕ�̬ƽ�⣬ƽ��ʱ��Ӧ���ڽ��У�����������Ӧ������и���ְٷֺ������䣻���䡱�������ı䣬ƽ�ⱻ���ƣ������µ������½����µĻ�ѧƽ�⣻��;���أ�����������䣬���淴Ӧ�����Ǵ�����Ӧ��ʼ�����Ǵ��淴Ӧ��ʼ�����ɽ���ͬһƽ��״̬����Ч����״̬�жϣ���v(B��)=v(B��)��v(C��):v(D��)=x : y��c(C)��C%��n(C)%�Ȳ������A��B��C��DΪ���壬��m+n��x+y��ѹǿ�㶨����ϵ��ɫ�����λʱ����ij�����ڻ�ѧ���Ķ����������γ�������ϵƽ��ʽ���㶨��m+n �� x+y���ȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л�������D�ĽṹΪ ![]() ����һ�ֳ������л��ܼ���������ͨ������������Ӧ�Ƶã���A
����һ�ֳ������л��ܼ���������ͨ������������Ӧ�Ƶã���A ![]() B
B ![]() C
C ![]() D���������˵������ȷ���ǣ� ��
D���������˵������ȷ���ǣ� ��
A.��AΪCH3CH3
B.��Ӧ��������ȥ��Ӧ
C.��Ӧ�٢ڢ۶�����ȡ����Ӧ
D.������D������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС��Ϊ̽��SO2�����ʣ�����ͼ��ʾװ�ý���ʵ�飮
��ش��������⣺
��1��װ��A��ʢ���������Ƶ����������� �����з�����Ӧ�Ļ�ѧ����ʽΪ�� ��
��2��ʵ������У�װ��B��C�з���������ֱ��� �� ��װ��B�з�����Ӧ�����ӷ���ʽΪ�� ��
��3��װ��D��Ŀ����̽��SO2��Ʒ�����õĿ����ԣ���д��ʵ����������� ��
��4��β���ɲ��á� ����Һ���գ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڱ�¶�ڿ����У����������ӵ������ǣ� ��
A.Ũ����B.Ũ����C.̼���ƾ���D.�Ȼ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���� �� ��
A. 1mol�� B. 1.5molH2O C. 2mol���� D. 3mol����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��FeCO3��ɰ�»��ÿ�������Ѫ����ʵ�������Ʊ�FeCO3��������ͼ��ʾ��

����˵���������
A. �����¶ȷ�ֹNH4HCO3��FeSO4�ֽ�
B. ������������CO2����ų�
C. ���˲����ij��ò����������ձ���©���Ͳ�����
D. ��ƷFeCO3�ڿ����и��·ֽ�ɵõ�������FeO
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��KClO3��6HCl��Ũ��===KCl��3Cl2����3H2O����ͼ��ʾ���������Լ��ֱ�����������е���Ӧλ�ã�ʵ��ʱ��Ũ�������KClO3�����ϣ����ñ�����Ǻá��±�����ʵ������ó��Ľ�����ȫ��ȷ����

ѡ�� | ʵ������ | ���� |
A | ����KSCN��FeCl2��Һ��� | Cl2���л�ԭ�� |
B | ���з�̪��NaOH��Һ��ɫ | Cl2�������� |
C | ��ɫʯ����Һ�ȱ�����ɫ | Cl2����Ư���� |
D | KI������Һ����ɫ | Cl2���������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧУ��ѧѧϰС��Ϊ̽���������������ʣ�����ͼ��ʾװ�ý���ʵ�顣

��ش��������⣺
��1��װ�ü���ʢ��Ũ���������A��������__________����װ���з�����Ӧ�Ļ�ѧ����ʽΪ_________________________��
��2��ʵ������У�װ���ҡ����г��ֵ�����ֱ��ǣ�____________________��____________________��װ�ñ��е��Թ��ڷ�����Ӧ�����ӷ���ʽΪ��_____________________��
��3��ȡ��װ�ñ��е��Թ�D�������еμ�FeSO4��Һ����Һ��Ϊ__________ɫ��Ϊ��֤����Ԫ���ڸ÷�Ӧ�еIJ������____________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ڹ������������������������ȶ��������Ҫ��;����ҵ�����������Ƶķ����ǽ���ȥ������̼�Ҹ����Ŀ���ͨ�����ڵ���(�¶�180~200��)�еõ������ƣ�Ȼ�����ӿ���������Ѹ�������¶���300~400�����ɵõ��������ơ�ij��ѧ��ȤС��ģ�ҵ�����Ʊ��������Ƶ�װ����ͼ��ʾ��

��ش�����������⡣
��1��Ũ�����������______________��
��2��������300~400��ʱ������Ҫ��Ӧ�Ļ�ѧ����ʽ��______________��
��3������ѡ���еļ��ȷ�ʽ�ʺϸ�ʵ�����_____(����ĸ)��
A.ˮԡ B.��ԣ(100~260��) C.���µ�¯(150~500��) D.�ƾ����(1000~1200��)
��4����Ҫ��߲�Ʒ���������ھ�֧�Թܺ�����һ��װ������װ��Ӧ����________��
��5���ھ�֧�Թܺ�����(4)����Ҫ���װ�ú���ijͬѧ����Ϊ�ƵõĹ��������л�����������ij������,��������________(�ѧʽ)��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com