
【题目】某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验.
请回答下列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是 ,其中发生反应的化学方程式为 .
(2)实验过程中,装置B、C中发生的现象分别是 、 ,装置B中发生反应的离子方程式为 ;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象 .
(4)尾气可采用 溶液吸收.
【答案】蒸馏烧瓶;Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O;溶液由紫红色变为无色;出现黄色浑浊;2MnO4﹣+5SO2+2H2O═2Mn2++5SO42﹣+4H+;待品红溶液完全褪色后,关闭分液漏斗的旋塞,点燃酒精灯加热;无色溶液恢复为红色;NaOH
【解析】(1)装置A中盛放亚硫酸钠的仪器名称是蒸馏烧瓶;亚硫酸钠与浓硫酸反应反应生成硫酸钠、二氧化硫气体和水,反应的化学方程式为:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O,
所以答案是:蒸馏烧瓶;Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O;
(2)高锰酸钾溶液为紫红色,具有氧化性,二氧化硫具有还原性,二者发生氧化还原反应,则观察到红色逐渐变浅直至完全褪去,二氧化硫进入硫化钠溶液中发生的氧化还原反应为2S2﹣+SO2+2H2O=3S↓+4OH﹣ , 则观察到出现黄色浑浊,高锰酸钾溶液和二氧化硫气体发生的离子反应为:2MnO4﹣+5SO2+2H2O═2Mn2++5SO42﹣+4H+ ,
所以答案是:溶液由紫红色变为无色;出现黄色浑浊;2MnO4﹣+5SO2+2H2O═2Mn2++5SO42﹣+4H+;
(3)因二氧化硫能使品红褪色,但加热褪色后的溶液又可恢复红色,则操作为待品红溶液完全褪色后,关闭分液漏斗的旋塞,点燃酒精灯加热,观察到的现象为无色溶液恢复为红色,
所以答案是:待品红溶液完全褪色后,关闭分液漏斗的旋塞,点燃酒精灯加热;无色溶液恢复为红色;
(4)利用氢氧化钠溶液来吸收尾气,发生的离子反应为SO2+2OH﹣=SO32﹣+H2O,所以答案是:NaOH.


科目:高中化学 来源: 题型:
【题目】乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物.完成下列各题: 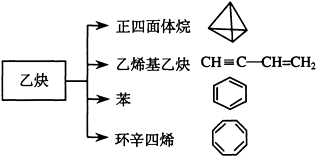
(1)正四面体烷的分子式为 , 其二氯取代产物有种
(2)关于乙烯基乙炔分子的说法错误的是:
a 能使酸性KMnO4溶液褪色
b 1摩尔乙烯基乙炔能与3摩尔Br2发生加成反应
c 生成乙烯基乙炔分子的反应属于取代反应
d 等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量不相同
(3)写出与环辛四烯互为同分异构体且属于芳香烃的分子的结构简式:
(4)写出与苯互为同系物且一氯代物只有两种的物质的结构简式(举两例):、
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了充分应用资源,用工业废碱液(Ca(OH)2、NaOH)与烟道气(回收成分SO2)来制取石膏(CaSO42H2O)和过二硫酸钠(Na2S2O8)。设计简要流程如图:
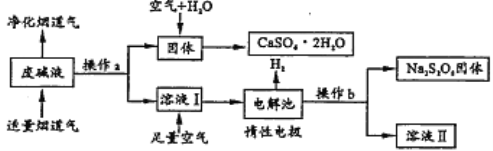
(1)烟道气中SO2与废碱生成沉淀的化学方程式为_____;操作a的名称是_____。
(2)生成CaSO42H2O过程中没有涉及到的化学反应类型为_____(填序号)。
A.复分解反应 B.化合反应 C.分解反应 D.氧化反应 E.置换反应
(3)溶液Ⅰ通入空气发生反应的化学方程式为_____。
(4)用惰性电极电解时,阳极生成Na2S2O8的电极反应为_____;在整个流程中可以循环利用的物质是H2O和_____(填化学式)。
(5)一定条件下将S8(s)、O2(g)、NaOH(s)转化过程中的能量关系用如图简单表示。则S8(s)燃烧的热化学反应方程式为_____。

(6)若制取ag Na2S2O8时,阳极有bL氧气(标况)产生。则电解生成的H2体积在标准状况下为_____L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用如图装置制取并收集氨气,请回答下列问题:
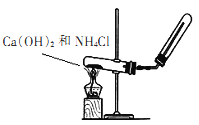
(1)写出大试管内发生反应的化学方程式:_____________。
(2)下列气体能采用如图收集方式的是___。
A.O2 B.NO C.H2
(3)若反应收集了336mL标况下氨气,将其配制成500mL溶液,其物质的量浓度为____mol/L。
(4)另取上述(3)所得溶液配制成0.0lmol/L溶液l00mL的过程中,不需要使用的仪器是(填代号)___。
A.烧杯 B.胶头滴管 C.玻璃棒 D.l00mL容量瓶 E.漏斗
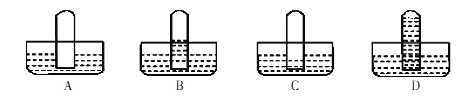
(5)某学生欲试验氨气的水溶性,将集满干燥氨气的试管倒置于水中,则其观察到的现象应该与______图一致。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ag Mg、Al合金完全溶解在C1mol/L、V1LHCl溶液中,产生bmolH2。再向反应后的溶液中加入C2mol/LV2L NaOH溶液,恰好使沉淀达到最大值,且沉淀质量为dg。下列关系不正确的是
A. d=a+34b B. ![]()
C. 铝的质量为![]() D. 与金属反应后剩余盐酸为(C1V1-2b)mol
D. 与金属反应后剩余盐酸为(C1V1-2b)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨在国民生产中占有重要的地位.工业合成氨的反应为:N2(g)+3H2(g)2NH3(g)△H=﹣92.4KJ/mol.请回答下列问题:
(1)表明合成氨反应处于平衡状态的是(填字母)
a.2v正(NH3)>3v逆(H2)b.c(N2)=c(H2)>c(NH3)
c.单位时间内有3molH﹣H键断裂,同时有6molN﹣H键断裂
d.恒温恒容时,容器内压强不变
e.恒温恒容时,容器内混合气体的弥补不变
(2)在一定条件下的密闭容器中,该反应达到平衡,既要加快反应速率,又要提高H2的转化率,可以采取的措施有(填字母)
a.升高温度 b.分离出液态氨气 c.增加N2浓度 d.增加H2浓度
(3)已知在400℃时,N2(g)+3H2(g)2NH3(g)的平衡常数K=0.5,则NH3(g)N2(g)+3H2(g)的平衡常数表达式为K= , 数值为 .
(4)有两个密闭容器A和B,A容器保持恒容,B容器爆出恒压,起始时向容积相等的A、B中分别通入等量的NH3气体,均发生反应:2NH3(g)3H2(g)+N2(g).则:
①达到平衡所需的时间:t(A)t(B),平衡时,NH3的转化率:a(A)a(B)(填“>”、“=”或“<”).
②达到平衡后,在两容器中分别通入等量的氦气.A中平衡向移动,B中平衡向移动.(填“向正反应方向”、“向逆反应方向”、“不”).
(5)在三个相同容器中各充入1molN2和3molH2 , 在不同条件下反应并达到平衡,氨的体积分数[Ψ(NH3)]随时间变化的曲线如图所示.下列说法中正确的是(填字母,下同). 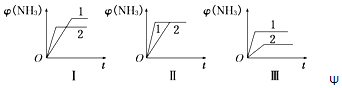
a.图Ⅰ可能是不同压强对反应的影响,且p2>p1
b.图Ⅱ可能是同温同压下不同催化剂对反应的影响,且催化剂性能1>2
c.图Ⅲ可能是不同温度对反应的影响,且T1>T2 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物结构简式如图,下列说法错误的是( ) ![]()
A.该有机物属于饱和链烃
B.该有机物可由两种单炔烃分别与氢气加成得到
C.该烃与2,3﹣二甲基丁烷互为同系物
D.该烃的一氯取代产物共有5种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com