
(10分)五种短周期元素A、B、C、D、E,原子序数逐渐增大,A、B处于同一周期,C、D、E同处另一周期。C、B可按原子个数比2∶l和1∶1分别形成两种离子化合物甲和乙。A原子的最外层电子数比次外层电子数多3个。E周期序数等于E原子最外层电子数。根据以上信息回答下列问题:
(1)A、B、C、D、E五种元素的原子半径由小到大的顺序是 (用元素符号填写)
(2)乙物质中存在的化学键类型是 。
(3)选用恰当的试剂除去D中少量的E,写出发生反应的化学方程式 。
(4)化合物乙的电子式 。
(5)将D、E的单质插入NAOH溶液中,构成原电池,其负极反应是 。
科目:高中化学 来源:2015-2016学年河北正定中学高二上学期第一次联考化学试卷(解析版) 题型:填空题
(12分)已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH CH3COO?+H+ ΔH>0。
CH3COO?+H+ ΔH>0。
(1)常温常压下,在 pH =5的稀醋酸溶液中,c(CH3COO?)=_________;下列方法中,可以使0.10 mol·L?1CH3COOH的电离程度增大的是___________。
a.加入少量0.10 mol·L?1的稀盐酸
b.加热CH3COOH溶液
c.加入少量冰醋酸
d.加水稀释至0.010 mol·L?1
e.加入少量氯化钠固体
f.加入少量0.10 mol·L?1的NaOH溶液
(2)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸)_________V(醋酸),反应的最初速率为:υ(盐酸)_________υ(醋酸)。
(3)常温下,向体积为Va mL pH=3的醋酸溶液中滴加pH=11的NaOH溶液Vb mL至溶液恰好呈中性,则Va与Vb的关系是:Va____Vb。
(4)已知:90℃时,水的离子积常数为Kw = 38×10?14,在此温度下,将pH=3的盐酸和pH = 11的氢氧化钠溶液等体积混合,则混合溶液中的c(H+)=__________(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源:2016届湖南省高三第一次测试理综化学试卷(解析版) 题型:填空题
(14分)A、B、C、D、E、F是原子序数依次增大的短周期主族元素,A的最外层电子数是次外层电子数2倍,B是短周期中金属性最强的元素,C是同周期中阳离子半径最小的元素,D元素的最高价氧化物对应水化物与B元素的最高价氧化物对应水化物反应的产物M是制备木材防火剂的原料,E的最外层电子数与内层电子数之比为3﹕5。请回答:
(1)D的元素符号为 。
(2)F在元素周期表中的位置 。
(3)用电子式表示由元素B和F组成的化合物的形成过程: 。
(4)B单质与氧气反应的产物与C的单质同时放入水中,产生两种无色气体,有关的化学方程式为 、 。
(5)工业上将干燥的F单质通入熔融的E单质中可制得化合物E2F2。该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,该反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年山西阳泉十五中高三第一次阶段考试化学试卷(解析版) 题型:选择题
下列混合物的分离或提纯操作中不正确的是
A.除去N2中的少量O2,可通过灼热的Cu网后,收集气体
B.除去Fe(OH)3胶体中混有的Cl- 离子,可用渗析的方法
C.除去乙醇中的少量NaCl,可用蒸馏的方法
D.重结晶、滴定操作都可用于提纯物质
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省三门峡市高二上学期入学考试化学试卷(解析版) 题型:选择题
对可逆反应N2(g)+3H2(g) 2NH3(g),△H=-92.4 kJ.mol-1下列叙述正确的是
2NH3(g),△H=-92.4 kJ.mol-1下列叙述正确的是
A.达到化学平衡时,若升高温度,则正反应速率减小,逆反应速率增大
B.若单位时间内消耗x mol N2,同时生成2x mol NH3,则反应达到平衡状态
C.若达到平衡时,共放出46.2kJ热量,则有l mo1NH3(g)生成
D.达到平衡后,将容器体积减小为原来的一半,重新达到平衡后,c(NH3)变为原平衡时的2倍
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河南省高二开学考试化学试卷(解析版) 题型:选择题
为预防“H1N1”甲型流感,同学们每天用“84”消毒液(NAClO溶液)消毒,下列说法不正确的是
A.NAClO溶液的消毒原理是使蛋白质变性
B.1 mol Cl2与足量NAOH溶液反应转移2 mol电子
C.NAClO溶液的漂白原理与NA2O2相同,与SO2不同
D.“84”消毒液与“洁厕灵”(盐酸)混合使用可能会产生有毒的氯气
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二上学期第一次月考化学试卷(解析版) 题型:选择题
今有如下三个热化学方程式:
H2(g)+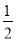 O 2(g)=H2O(g) ΔH=a kJ·mol-1;
O 2(g)=H2O(g) ΔH=a kJ·mol-1;
H2(g)+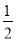 O 2(g)=H2O(l) ΔH=b kJ·mol-1;
O 2(g)=H2O(l) ΔH=b kJ·mol-1;
2H2(g)+O2(g)=2H2O(l) ΔH=c kJ·mol-1。
关于它们的下列表述正确的是
A.三个都是吸热反应 B.a、b、c均为正值
C.a=b D.2b=c
查看答案和解析>>
科目:高中化学 来源:2016届湖南省衡阳市高三上学期第一次月考化学试卷(解析版) 题型:填空题
向2 L密闭容器中通入a mol气体A和b mol气体B,在一定条件下发生反应:xA(g)+yB(g) pC(g)+qD(g),已知:平均反应速率vC=
pC(g)+qD(g),已知:平均反应速率vC=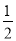 vA;反应2 min时,A的物质的量减少了
vA;反应2 min时,A的物质的量减少了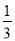 ,B的物质的量减少了
,B的物质的量减少了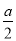 mol,有a mol D生成。回答下列问题:
mol,有a mol D生成。回答下列问题:
(1)反应2 min内,vA=_____mol/(L·min);
(2)化学方程式中,x:y:p:q= ;
(3)反应平衡时,D为2a mol,则B的转化率为________;
(4)如果只升高反应温度,其他反应条件不变,平衡时D为1.5 a mol,则该反应的ΔH________0;(填“>”“<”或“=”)
(5)如果其他条件不变,将容器的容积变为1 L,进行同样的实验,则与上述反应比较:
①反应速率_____,(填“增大”、“减小”或“不变”)理由是 ;
②平衡时反应物的转化率________,(填“增大”、“减小”或“不变”)
理由是 。
查看答案和解析>>
科目:高中化学 来源:2016届重庆市高三上学期开学考试化学试卷(解析版) 题型:实验题
(14分)铈、铬、钛、镍虽不是中学阶段常见的金属元素,但在工业生产中有着重要作用。
(1)二氧化铈 (CeO2)在平板电视显示屏中有着重要应用。CeO2在稀硫酸和H2O2的作用下可生成Ce3+,CeO2在该反应中作_____剂。
(2)自然界Cr主要以+3价和+6价存在。+6价的Cr能引起细胞的突变,可以用亚硫酸钠将其还原为+3价的铬。完成并配平下列离子方程式:
__Cr2O72-+__SO32-+__ =__Cr3++__SO42-+ __H2O
=__Cr3++__SO42-+ __H2O
(3)钛(Ti)被誉为“二十一世纪的金属”,工业上在550℃时用钠与四氯化钛反应可制得钛,该反应的化学方程式是 。
(4)NiSO4·xH2O是一种绿色易溶于水的晶体,广泛用于镀镍、电池等,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得。操作步骤如下:

 ①向滤液Ⅰ中加入FeS是为了除去Cu2+、Zn2+等杂质,除去Cu2+的离子方程式为__________。
①向滤液Ⅰ中加入FeS是为了除去Cu2+、Zn2+等杂质,除去Cu2+的离子方程式为__________。
②对滤液Ⅱ先加H2O2再调pH,调pH的目的是 。
③滤液Ⅲ溶质的主要成分是NiSO4,加Na2CO3过滤后,再加适量稀硫酸溶解又生成NiSO4,这两步操作的目的是____________。
④为测定NiSO4·xH2O晶体中x的值,称取26.3 g晶体加热至完全失去结晶水,剩余固体15.5 g,列式计算x的值等于 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com