
| A. | 用醋酸溶解碳酸钙:2CH3COOH+CaCO3=2CH3COO-+Ca2++CO2↑+H2O | |
| B. | 碳酸氢钠溶液中加入足量热的氢氧化钠溶液:HCO3-+OH-=CO32-+H2O | |
| C. | 用氯酸钠的酸性溶液与H2O2作用制取ClO2:4ClO3-+4H2O2+4H+=4ClO2↑+3O2↑+6H2O | |
| D. | 用硫酸酸化的桔红色的重铬酸钾(K2Cr2O7)溶液与乙醇作用生成乙酸和草绿色三价铬,用于检测是否酒后驾驶:2Cr2O72-+3C2H5OH+16H+→4Cr3++3CH3COOH+11H2O |
分析 A.醋酸和碳酸钙反应生成醋酸钙、二氧化碳气体和水,醋酸和碳酸钙都需要保留化学式;
B.氢氧化钠足量时,反应生成碳酸钠和水;
C.4mol氯酸根离子转化成化ClO2得到4mol电子,4mol双氧水完全反应失去8mol电子,该反应不满足电荷守恒;
D.重铬酸钾具有强氧化性,能够将乙醇氧化成乙酸,同时被还原成草绿色三价铬离子.
解答 解:A.用醋酸溶解碳酸钙,醋酸和碳酸钙都不能拆开,反应的离子方程式为:2CH3COOH+CaCO3=2CH3COO-+Ca2++CO2↑+H2O,故A正确;
B.碳酸氢钠溶液中加入足量热的氢氧化钠溶液,反应生成碳酸钠和水,反应的离子方程式为:HCO3-+OH-=CO32-+H2O,故B正确;
C.用氯酸钠的酸性溶液与H2O2作用制取ClO2,该反应不满足电子守恒,正确的离子方程式为:4ClO3-+2H2O2+4H+=4ClO2↑+2O2↑+4H2O,故C错误;
D.用硫酸酸化的桔红色的重铬酸钾(K2Cr2O7)溶液与乙醇作用生成乙酸和草绿色三价铬,用于检测是否酒后驾驶,反应的离子方程式为:2Cr2O72-+3C2H5OH+16H+→4Cr3++3CH3COOH+11H2O,故D正确;
故选C.
点评 本题考查了离子方程式的正误判断,为高考的高频题,题目难度不大,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.


科目:高中化学 来源: 题型:推断题
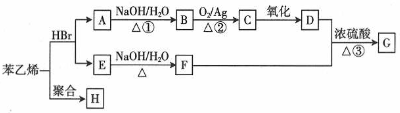
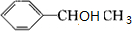 ;H的结构简式
;H的结构简式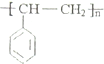 .
.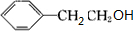 +O2$→_{△}^{Ag}$2
+O2$→_{△}^{Ag}$2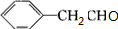 +2H2O ③
+2H2O ③ +
+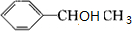 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$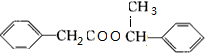 +H2O
+H2O .(任写一种)
.(任写一种)查看答案和解析>>
科目:高中化学 来源: 题型:实验题
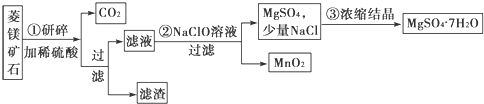
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 .
.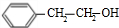 +O2$→_{△}^{Cu}$2
+O2$→_{△}^{Cu}$2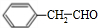 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时,溶液中H+向PbO2电极迁移 | |
| B. | 放电时,电路中转移0.2mol电子时Pb电极质量减小20.7g | |
| C. | 充电时,电解质溶液的pH增大 | |
| D. | 充电时,阴极的电极反应式为:PbSO4+2H2O-2e-=PbO2+4H++SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L的H2O2中所含H原子个数远大于2NA | |
| B. | 常温常压下,14.2g的Na2SO4和Na2S2O3的混合物含有Na原子个数为0.4NA | |
| C. | 标准状况下,130.5g的MnO2粉末与足量浓盐酸共热转移电子数目小于3NA | |
| D. | 常温常压下,足量的金属Al与1mol Cl2共热,转移电子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子中键能越大,键长越长,则分子越稳定 | |
| B. | 元素周期表中的第ⅠA族(除H外)和第ⅦA族元素的原子间可能形成共价键 | |
| C. | 水分子可表示为H-O-H,分子中键角为180° | |
| D. | H-O键键能为463 kJ•mol-1,即18 g H2O分解成H2和O2时,消耗能量为2×463 kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com