
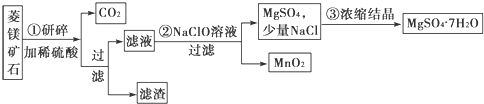
分析 菱镁矿石(主要成分是MgCO3,并含有MnCO3,SiO2杂质)研碎加稀硫酸,SiO2不反应,MgCO3,MnCO3反应生成二氧化碳气体,MgSO4、MnSO4溶液,向滤液中加NaClO,Mn2+被氧化为+4价,变成MnO2沉淀,溶液中含有MgSO4和少量NaCl,浓缩结晶、过滤洗涤,得MgSO4•7H2O晶体;
(1)菱镁矿石研碎的目的是使菱镁矿石变成粉状,加稀硫酸溶解时反应速率快,MgCO3和MnCO3与稀硫酸反应生成MgSO4、MnSO4;滤渣二氧化硅在生产生活中有广泛应用制玻璃和光导纤维;
(2)第②步反应为向含有MgSO4、MnSO4的溶液中加NaClO,Mn2+有还原性,ClO-有氧化性,Mn2+被氧化为+4价,变成MnO2沉淀,ClO-被还原成Cl-,然后缺项配平;
(3)菱镁矿石(主要成分是MgCO3,并含有MnCO3,SiO2杂质)中的元素最终存在形式:MgCO3变为82.00gMgSO4•7H2O,MnCO3变为1.74gMnO2,SiO2杂质在第①步以滤渣形式存在,质量为4.70克,m(菱镁矿)=m(MgCO3)+m(MnCO3)+m(不溶物)=28.00g+2.30g+4.70g=35.00g,计算得到菱镁矿石中MgCO3的质量分数.
解答 解:菱镁矿石(主要成分是MgCO3,并含有MnCO3,SiO2杂质)研碎加稀硫酸,SiO2不反应,MgCO3,MnCO3反应生成二氧化碳气体,MgSO4、MnSO4溶液,向滤液中加NaClO,Mn2+被氧化为+4价,变成MnO2沉淀,溶液中含有MgSO4和少量NaCl,浓缩结晶、过滤洗涤,得MgSO4•7H2O晶体;
(1)菱镁矿石研碎的目的是使菱镁矿石变成粉状,加稀硫酸溶解时反应速率快,发生反应:MgCO3+H2SO4=MgSO4+H2O+CO2↑;MnCO3+H2SO4=MnSO4+H2O+CO2↑,SiO2杂质不和稀硫酸反应,故滤液中含有MgSO4,MnSO4;
故答案为:使溶解充分并加快溶解速率;MgSO4;MnSO4;
(2)第②步反应为向含有MgSO4、MnSO4的溶液中加NaClO,Mn2+有还原性,ClO-有氧化性,Mn2+被氧化为+4价,变成MnO2沉淀,ClO-被还原成Cl-,根据氧化还原反应得失电子相等知,Mn2+和ClO-的系数之比为1:1,该溶液为酸性溶液,故反应中不出现OH-;
故答案为:Mn2++ClO-+H2O=MnO2↓+Cl-+2H+;
(3)由原子守恒知生成1molMgSO4•7H2O,消耗1molMgCO3,即n(MgCO3)=n(MgSO4•7H2O),m(MgCO3)=$\frac{82.00g}{246g/mol}$×84g/mol=28.00g;
同理:n(MnCO3)=n(MnO2),m(MnCO3)=$\frac{1.74g}{87g/mol}$×115g/mol=2.30g,菱镁矿石的质量为:m(菱镁矿)=m(MgCO3)+m(MnCO3)+m(不溶物)=28.00g+2.30g+4.70g=35.00g,菱镁矿石中MgCO3的质量分数=$\frac{m(MgC{O}_{3})}{m(菱镁矿)}$×100%=$\frac{28.00g}{35.00g}$×100%=80%;
故答案为:80%.
点评 本题考查了物质分离的实验设计和方法应用,主要是利用氧化还原反应除去杂质Mn2+,得到较纯净的MgSO4溶液来制备MgSO4•7H2O晶体,同时考查了物质分离方法,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 向漂白液中通入少量二氧化碳:ClO-+H2O+CO2═${CO}_{3}^{2-}$+2HClO | |
| B. | 常温时偏铝酸钠溶液pH>7:${AlO}_{2}^{-}$+2H2O═Al(OH)3↓+OH- | |
| C. | 等物质的量浓度的FeI2溶液与溴水等体积混合:2Fe2++2I-+2Br2═2Fe3++I2+4Br- | |
| D. | 向硫酸氢钠溶液中滴加Ba(OH)2溶液恰好至沉淀完全:H++${SO}_{4}^{2-}$+Ba2++OH-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将溶质物质的量之比为2:7的三氯化铝溶液和氢氧化钡溶液混合2Al3++7OH-═Al(OH)3↓+AlO2-+2H2O | |
| B. | 将溶质物质的量之比为4:3的 硫酸氢钠和氢氧化钡溶液两溶液混合:4H++3SO42-+3Ba2++4OH-═3BaSO4↓+4H2O | |
| C. | 用石墨电极电解碘化镁溶液 2 I--2 e-=I 2 | |
| D. | 将16.8g 铁粉投入100mL 4.0mol/L的HNO3溶液中(还原产物只有NO)6Fe+20 H++5NO3-═3Fe2++3Fe3++5NO↑+10H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数是34 | B. | 最高价氧化物的化学式为SeO3 | ||
| C. | 金属性比较强 | D. | 气态氢化物的化学式为H2Se |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 冰毒的摩尔质量为149 | |
| B. | 海洛因和杜冷丁均能与溴水发生加成反应 | |
| C. | 1mol可卡因最多能与2molNaOH发生反应 | |
| D. | 以上毒品均属于芳香烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用醋酸溶解碳酸钙:2CH3COOH+CaCO3=2CH3COO-+Ca2++CO2↑+H2O | |
| B. | 碳酸氢钠溶液中加入足量热的氢氧化钠溶液:HCO3-+OH-=CO32-+H2O | |
| C. | 用氯酸钠的酸性溶液与H2O2作用制取ClO2:4ClO3-+4H2O2+4H+=4ClO2↑+3O2↑+6H2O | |
| D. | 用硫酸酸化的桔红色的重铬酸钾(K2Cr2O7)溶液与乙醇作用生成乙酸和草绿色三价铬,用于检测是否酒后驾驶:2Cr2O72-+3C2H5OH+16H+→4Cr3++3CH3COOH+11H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 50ml盐酸 | 50ml盐酸 | 50ml盐酸 | |
| m(混合物) | 9.2g | 15.7g | 27.6g |
| V(CO2)(标况) | 2.24L | 3.36L | 3.36L |
| A. | 15.7g混合物能恰好与盐酸完全反应 | |
| B. | 根据表中数据不能计算出混合物中NaHCO3的质量分数 | |
| C. | 向50ml盐酸中加入混合物27.6g时,盐酸过量 | |
| D. | 盐酸的物质的量浓度为3.0mol/L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com