
分析 (1)根据操作步骤选取实验仪器,根据仪器的用途来分析需要查漏的仪器以及查漏的方法;
(2)根据溶液稀释前后溶质的物质的量不变计算所需浓硫酸溶液的体积;根据浓硫酸的体积选取量筒,注意所选量筒的容积应稍大于或等于量取溶液的体积;
(3)根据c=$\frac{n}{V}$,分析操作对溶质的物质的量或对溶液的体积的影响判断.
解答 解:(1)配制200ml 1mol/L的稀硫酸,配制步骤有量取、稀释、移液、洗涤、定容、摇匀等操作,一般用量筒量取浓硫酸溶液在烧杯中稀释,冷却后转移到250mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器有玻璃棒、量筒、胶头滴管、小烧杯、250ml容量瓶,实验室没有200ml容量瓶,
故答案为:250mL的容量瓶;
(2)浓硫酸的物质的量浓度为c=$\frac{1000ρw}{M}$=18.4mol/L;设需要浓硫酸的体积为V,1mol/L×250mL=18.4mol/L×V,V=13.6mL,量筒的容积应稍大于或等于量取溶液的体积,
故答案为:13.6mL;③;
(3)①洗涤量取浓硫酸的量筒,并将洗涤液转移到定量瓶中,使得硫酸溶质偏多,浓度偏高;
②未等稀释后的硫酸溶液冷却至室温就转移到容量瓶中,根据热胀冷缩的原理,体积缩小,浓度偏高;
③转移前,容量瓶中含有少量蒸馏水,对所配制溶液浓度无影响;
④未洗涤稀释浓硫酸时用过的烧杯和玻璃棒,造成硫酸溶质损失,浓度偏低;
⑤定容时,仰视刻度线,会导致溶液体积偏大,则溶液浓度偏低;
故能引起所配稀硫酸的浓度偏低的是④⑤,
故答案为:④⑤.
点评 本题考查了一定物质的量浓度溶液的配制,难度不大,会根据量取溶液的体积正确选取量筒.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×10-5 | 4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
| A. | 等物质的量浓度的各溶液 pH 关系为:pH ( NaCN)>pH(Na2CO3)>pH( CH3COONa) | |
| B. | 浓度均为0.2mol/L NaHCO3和 Na2CO3溶液中,存在的粒子种类不相同 | |
| C. | 0.4 mol•L-1HCN 溶液与 0.2 mol•L-1NaOH 溶液等体积混合后,所得溶液中:c(Na+)>c(OH-)>c(H+) | |
| D. | 25℃时,pH=4且浓度均为0.1 mol•L-1的 CH3COOH、CH3COONa混合溶液中:c(Na+)+c(H+)>c(CH3COO-)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示.下列有关a、b、c三点的说法中正确的是( )
一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示.下列有关a、b、c三点的说法中正确的是( )| A. | 醋酸的电离程度由大到小的顺序:b>c>a | |
| B. | 溶液的pH由大到小的顺序:a>c>b | |
| C. | 用湿润的pH试纸测量醋酸溶液的pH,测量结果均偏大 | |
| D. | 溶液中$\frac{{c(C{H_3}COOH)}}{{c(C{H_3}CO{O^-})}}$的数值不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
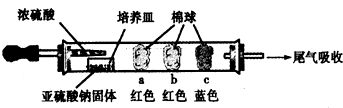
| 棉球 | 棉球上滴加的试剂 | 实验现象 | 解释和结论 |
| a | 品红试液 | 棉球变白,微热后又恢复红色 | SO2具有漂白性,且为暂时性漂白 |
| b | 含酚酞的NaOH溶液 | 棉球变为白色 | 离子方程式:2OHˉ+SO2 =SO32ˉ+H2O或OHˉ+SO2=HSO3ˉ |
| c | 含淀粉的碘水 | 棉球变为白色 | 该气体具有还原性 (选填“氧化性”或“还原性”) |
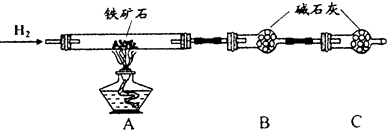
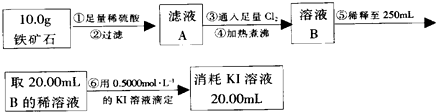
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
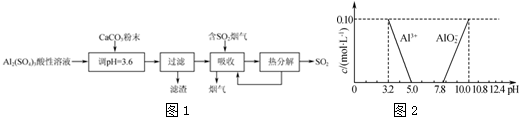
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
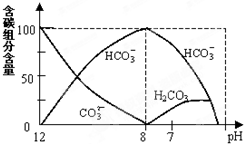 在含有弱电解质的溶液中,往往有多个化学平衡共存
在含有弱电解质的溶液中,往往有多个化学平衡共存查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com