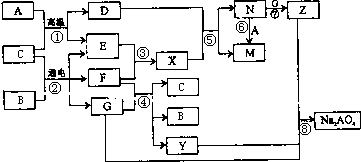
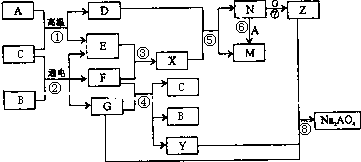
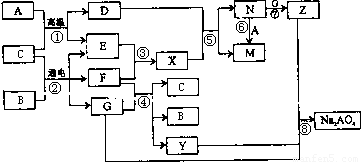
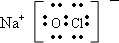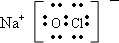解:A是生活中广泛使用的金属单质,常温下C是一种常见液体化合物,E、F、X均为气体.结合转化关系和反应条件,可以推断,A+C=D+E的反应是铁和水蒸气发生的反应;B+C通电电解得到EFG,EF为气体,判断是电解食盐水的反应,C为H
2O,B为NaCl,A为Fe,E为H
2,F为Cl
2,G为NaOH,D为Fe
3O
4;X为HCl,N为FeCl
3,M为FeCl
2,Z为Fe(OH)
3;
转化关系中的反应:F(Cl
2)+G(NaOH)=C(H
2O)+B(NaCl)+Y(NaClO);判断Y为NaClO;
(1)Y为NaClO电子式为:

,故答案为:

;
(2)在①~⑧中属于氧化还原反应,但又不是化合反应的是,①是铁和水蒸气发生的置换反应,是氧化还原反应;②电解氯化钠是氧化还原反应,不是化合反应;③氢气和氯气反应生成氯化氢,是氧化还原反应,属于化合反应;④是氯气和氢氧化钠反应是氧化还原反应,不是化合反应;⑤是四氧化三铁和盐酸反应,不是氧化还原反应不是化合反应;⑥是氯化铁和铁反应生成氯化亚铁,是氧化还原反应,是化合反应;⑦氯化铁和氢氧化钠反应是复分解反应;⑧是氧化还原反应,不是化合反应;综上所述②④⑧符合,
故答案为;①②④⑧;
(3)反应⑤是四氧化三铁和盐酸反应,反应的离子方程式是Fe
3O
4+8H
+=2Fe
3++Fe
2++4H
2O,故答案为:Fe
3O
4+8H
+=2Fe
3++Fe
2++4H
2O;
(4)反应④是Cl
2+2NaOH=NaCl+NaClO+H
2O;1molCl
2反应,电子转移1mol,反应中转移电子数为2N
A,则反应的氯气为2mol,则消耗的F(Cl
2)在标准状况下的体积为44.8L,
故答案为:44.8;
(5)反应⑧是氢氧化钠、氢氧化铁和次氯酸钠发生的反应生成Na
2FeO
4,铁元素化合价升高,氢氧化铁做还原剂,次氯酸钠做氧化剂被还原为氯离子,依据原子守恒配平写出
的化学方程式是:2Fe(OH)
3+4NaOH+3NaClO=Na
2FeO
4+3NaCl+5H
2O,故答案为:2Fe(OH)
3+4NaOH+3NaClO=Na
2FeO
4+3NaCl+5H
2O.
分析:A是生活中广泛使用的金属单质,常温下C是一种常见液体化合物,E、F、X均为气体.结合转化关系和反应条件,可以推断,A+C=D+E的反应是铁和水蒸气发生的反应;B+C通电电解得到EFG,EF为气体,判断是电解食盐水的反应,C为H
2O,B为NaCl,A为Fe,E为H
2,F为Cl
2,G为NaOH,D为Fe
3O
4;X为HCl,N为FeCl
3,M为FeCl
2,Z为Fe(OH)
3;
转化关系中的反应:F(Cl
2)+G(NaOH)=C(H
2O)+B(NaCl)+Y(NaClO);判断Y为NaClO,物质Y和Na
2AO
4均有强氧化性,可用于杀菌消毒,Z是一种红褐色固体.证明上述推断符合要求;依据判断出的物质回答问题.
点评:本题考查了物质转化关系的推断应用,物质性质的综合应用,主要考查氯及其化合物、铁及其化合物性质的推断和性质应用,电子式、离子方程式、化学方程式的书写方法,难度中等.

 ,故答案为:
,故答案为: ;
;