
【题目】下列分子含有非极性键的极性分子的是
A. ![]() B. C60C. HCND. CH3CH2Cl
B. C60C. HCND. CH3CH2Cl
科目:高中化学 来源: 题型:
【题目】有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
实验装置 |
|
|
|
|
部分实验现象 | a极质量减小b极质量增加 | 溶液中的SO42-向b极移动 | d极溶解c极有气体产生 | 电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是
A.a>b>c>dB.b>c>d>aC.d>a>b>cD.a>b>d>c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钠元素、钴元素在工业上有重要的应用。请回答下列问题:
(1)Ca大于Co的是________(填标号)
A. 最外层电子数 B. 原子半径
C. 第一电离能 D. 未成对电子数
(2)经X射线衍射法测定发现,晶体钴在417℃以上堆积方式的剖面图如图所示,则该堆积方式属于_____,若该堆积方式下的晶胞参数为a cm,则钴原子的半径为______pm。
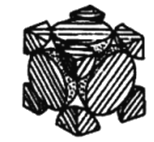
(3)Co3+氧化性极强,在水溶液中易被还原成Co2+,而在氨水中可稳定存在,其原因是________。
(4)已知:配合物中,配位体中含有一个配位原子的配体称为单齿配体;一个配体中有两个或两个以上配位原子的配体称为多齿配体。[Co(NO3—)4]2—中Co2+的配位数为4,该配离子中各元素第一电离能由大到小的顺序_______(填元素符号),1mol该离子中含σ键数目为_________。
(5)①Co的某配合物化学式为CoCl3·3NH3,为八面体结构,其中极性分子有___种。
②该配合物在热NaOH溶液中发生反应产生沉淀,并释放出气体,该反应的化学方程式_________。
(6)NaCl晶体在50~300GPa的高压下和Cl2反应,可以形成一种新晶体,其立方晶胞如下图所示(大球为Cl,小球为Na)。
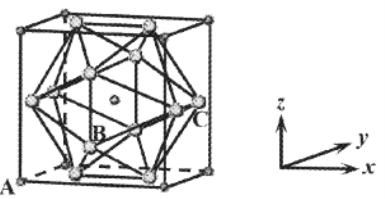
①若A的原子坐标为(0,0,0),C的原子坐标为(1,![]() ,
,![]() ),则B的原子坐标为________。
),则B的原子坐标为________。
②晶体中,Cl构成的多面体包含_____个三角形的面,与Cl紧邻的Na个数为______。
(7)钴蓝晶体结构如下图,该立方晶胞由I型和II型小立方体各4个构成,其化学式为_____,晶体中Al3+占据O2—形成的_____面体空隙,NA为阿伏伽德罗常数的值,设化学式对应的摩尔质量为Mg/mol,则钴蓝晶体的密度计算式为_________g/cm3。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关热化学方程式书写与对应表述均正确的是
A. 稀硫酸与0.1 mol·L-1 NaOH溶液反应:H+(aq)+OH-(aq)=H2O(l) ΔH=+57.3 kJ·mol-1
B. 在101 kPa下H2(g)的燃烧热为285.8 kJ·mol-1,则水分解的热化学方程式:2H2O(l)=2H2(g)+O2(g) ΔH=+285.8 kJ·mol-1
C. 已知CH3OH的燃烧热为726.8 kJ·mol-1,则有CH3OH(l)+![]() O2(g)=CO2(g)+2H2O(g) ΔH=-726.8 kJ·mol-1
O2(g)=CO2(g)+2H2O(g) ΔH=-726.8 kJ·mol-1
D. 已知9.6 g硫粉与11.2 g铁粉混合加热生成17.6 g FeS时放出19.12 kJ热量,则Fe(s)+S(s)=FeS(s) ΔH=-95.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列分子中的中心原子杂化轨道的类型相同的是( )
A. CO2与SO2 B. CH4与NH3 C. BeCl2与BF3 D. C2H2与C2H4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50mL0.50mol/L盐酸与50mL0.55mol/L NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
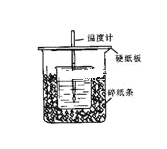
(1)从实验装置上看,图中尚缺少的一种玻璃用品是___。
(2)烧杯间填满碎纸条的作用是___。
(3)大烧杯上如不盖硬纸板,求得的中和热数值___(填“偏大、偏小、无影响”)。
(4)如果用60mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量___(填“相等、不相等”),所求中和热___(填“相等、不相等”)。
(5)用相同浓度和体积的氨水(NH3H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会___;(填“偏大”、“偏小”、“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中含有较大量的Cl﹣、![]() 、OH﹣等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是( )
、OH﹣等3种阴离子,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是( )
①滴加Mg(NO3)2溶液;②过滤;③滴加AgNO3溶液;④滴加Ba(NO3)2溶液
A.①②④②③B.④②①②③C.①②③②④D.④②③②①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酚酯的合成方法之一是由酚与酰卤(![]() )反应制得。
)反应制得。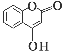 是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
是一种医药中间体,常用来制备抗凝血药,可通过下列路线合成:
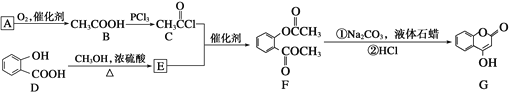
(1)A与银氨溶液反应有银镜生成,则A的结构简式是_________。
(2)B→C的反应类型是_________。
(3)E的结构简式是__________________。
(4)写出F和过量NaOH溶液共热时反应的化学方程式:__________。
(5)下列关于G的说法不正确的是________(填序号)。
a.能与溴单质反应 b.能与金属钠反应
c.1 mol G最多能和3 mol氢气反应 d.分子式是C9H6O3
(6)写出符合下列要求的D的所有同分异构体的结构简式_____。
①遇FeCl3溶液发生显色反应;
②能发生银镜反应
③最多能消耗3molNaOH。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z为短周期内除稀有气体外的4种元素,它们的原子序数依次增大,其中只有Y为金属元素。Y和W的最外层电子数相等。Y、Z两元素原子的质子数之和为W、X两元素质子数之和的3倍。完成下列问题:
(1)写出元素符号:W为________,X为_________,Y为__________,Z为__________。
(2)W2Z是由___________键组成的分子,其电子式为___________。
(3)由Y、X、W组成的物质是由_________键和__________键组成的___________化合物。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com