
| ����� | �� | �� | �� |
| ����ʱ����ζ | ������ζ | ��ֽ��ζ | �ս���ë��ζ |
���� �ٲ������մɡ�ˮ���о����й����Σ����ڹ����β��ϣ������մɵ�ԭ��Ϊճ��������Ҫʹ��ʯ��ʯ��������벣������Ҫ�ɷֶ������跢����Ӧ�������ķ����������ˮ��
����ë�ijɷ��ǵ����ʣ����ijɷ�����ά�أ�
��� �⣺�ٲ������մɡ�ˮ��ɷ��к��й��������ڹ����β��ϣ�Ҳ�������ǽ������ϣ��մɵ�����ԭ��Ϊճ��������Ҫʹ��ʯ��ʯ��������벣������Ҫ�ɷֶ������跢����Ӧ�������ķ����������ˮ����Ӧ�Ļ�ѧ����ʽΪ��4HF+SiO2=SiF4��+2H2O��
�ʴ�Ϊ�����ǽ������ϣ��մɣ�4HF+SiO2=SiF4��+2H2O��
����ë�ijɷ��ǵ����ʣ�������ë���ս���ë����ζ�����ijɷ�����ά�أ���ֽ��ͬ��������ֽ��ζ��
�ʴ�Ϊ���ۣ��ڣ�
���� ������Ҫ�����˲��Ϸ����Լ����ʣ�����Ĺؼ��ǶԳ����л�����ǽ������ϼ��������ϵ���ʶ����Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
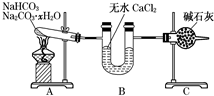 NaHCO3��Na2CO3•xH2O�Ļ���Ϊ�˲ⶨxֵ��ijͬѧ������ͼ��ʾ��װ�ý���ʵ�飨CaCl2����ʯ�Ҿ���������
NaHCO3��Na2CO3•xH2O�Ļ���Ϊ�˲ⶨxֵ��ijͬѧ������ͼ��ʾ��װ�ý���ʵ�飨CaCl2����ʯ�Ҿ����������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��λʱ��������a mol A��ͬʱ����2a mol C | |
| B�� | ��������ѹǿ���ٱ仯 | |
| C�� | ��λʱ��������a mol A��ͬʱ����a mol B | |
| D�� | B�����Ũ�Ȳ��ٷ����仯 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ϴ��������ƿ�в�������������ˮ | B�� | �ܽ�NaOH���ձ�δϴ�� | ||
| C�� | ����NaOHʱʹ�ó���ֽ | D�� | ����ʱ���ӿ̶��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| Fe | Cu | Zn | Ag | Au | W | |
| �۵�/�� | 1535 | 1083 | 419.5 | 960.8 | 1063 | 3380 |
| �е�/�� | 3000 | 2595 | 907 | 2212 | 2707 | 5627 |
| A�� | Fe��Ag | B�� | Ag��Au | C�� | Zn��W | D�� | Fe��Au |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ij�¶�ʱ��2L������X��Y��Z������̬���ʵ����ʵ�����n����ʱ�䣨t���仯��������ͼ��ʾ����ͼ�����ݷ�����
ij�¶�ʱ��2L������X��Y��Z������̬���ʵ����ʵ�����n����ʱ�䣨t���仯��������ͼ��ʾ����ͼ�����ݷ������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
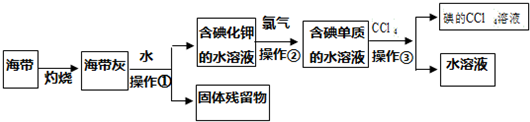
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ͨ������CO2�����Һ�У�Na+��SiO32-��CH3COO-��CO32- | |
| B�� | ������Һ�У�Fe3+��MnO4-��SO42-��K+ | |
| C�� | ������Һ�У�Na+��ClO-��SO42-��I- | |
| D�� | $\frac{c��{H}^{+}��}{c��O{H}^{-}��}$=1012����Һ�У�NH4+��Al3+��NO3-��Cl- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ˫��ˮ����Ҫ����;��Ư��ɱ���������ڻ�����������ѧ�ϳɺ�ҵ���������Ź㷺��Ӧ�ã��������ϵ�֪����ҵ���õ��KHSO4������Һ��ȡH2O2����ͼ��ʾ��
˫��ˮ����Ҫ����;��Ư��ɱ���������ڻ�����������ѧ�ϳɺ�ҵ���������Ź㷺��Ӧ�ã��������ϵ�֪����ҵ���õ��KHSO4������Һ��ȡH2O2����ͼ��ʾ���鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com