
| A、饱和石灰水中加入一定量的生石灰,温度明显升高,Ksp减少 |
| B、向CaCl2 溶液中通入CO2气体不能产生沉淀,是因为c(Ca2+ )?c(CO32-)>Ksp(CaCO3) |
| C、向BaCl2 溶液中加入等量的同浓度的 Na2CO3 和Na2SO4 溶液先产生BaSO4沉淀,则Ksp(BaSO4)>Ksp(BaCO3) |
| D、Ksp小的物质的溶解能力一定比Ksp大的物质小 |


科目:高中化学 来源: 题型:
| A、根据酸分子中含氢原子个数将酸分为一元酸、二元酸等 |
| B、根据反应中是否有电子转移将化学反应分为氧化还原反应和非氧化还原反应 |
| C、根据元素原子最外层电子数的多少将元素分为金属和非金属 |
| D、根据电解质在熔融状态下能否完全电离将电解质分为强电解质和弱电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、48g | B、62.5g |
| C、23g | D、31g |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
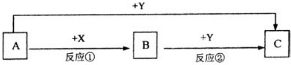 A、B、C三种物质的转化关系如图所示(部分产物已略去)
A、B、C三种物质的转化关系如图所示(部分产物已略去)查看答案和解析>>
科目:高中化学 来源: 题型:
| A、(a) | B、(b) |
| C、(a)(c) | D、(a)(d) |
查看答案和解析>>
科目:高中化学 来源: 题型:
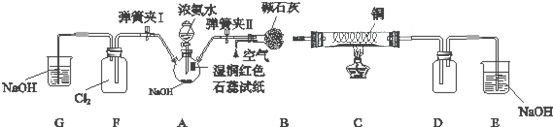
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com