
| A、48g | B、62.5g |
| C、23g | D、31g |
 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
| A、Cu与FeCl3溶液反应:Cu+2Fe3+=2Fe2++Cu2+ |
| B、铁与稀H2SO4反应:2Fe+6H+=2Fe3++3H2↑ |
| C、向AlCl3溶液中滴入过量NaOH溶液:Al3++3OH-=Al(OH)3↓ |
| D、Na与水反应:Na+2H2O=Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
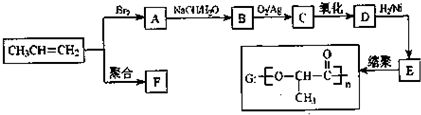
查看答案和解析>>
科目:高中化学 来源: 题型:

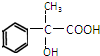 ,回答下列问题:
,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | HA物质的量浓度(mol/L) | NaOH物质的量浓度 (mol/L) | 混合溶液的PH |
| 甲 | 0.2 | 0.2 | a |
| 乙 | c1 | 0.2 | 7 |
| 丙 | 0.2 | 0.1 | 7 |
| 丁 | 0.1 | 0.1 | 9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、饱和石灰水中加入一定量的生石灰,温度明显升高,Ksp减少 |
| B、向CaCl2 溶液中通入CO2气体不能产生沉淀,是因为c(Ca2+ )?c(CO32-)>Ksp(CaCO3) |
| C、向BaCl2 溶液中加入等量的同浓度的 Na2CO3 和Na2SO4 溶液先产生BaSO4沉淀,则Ksp(BaSO4)>Ksp(BaCO3) |
| D、Ksp小的物质的溶解能力一定比Ksp大的物质小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用润湿的pH试纸测定饱和Na2CO3溶液的pH |
| B、向同pH、同体积的醋酸和盐酸溶液中加入足量镁粉,通过完全反应后收集到的H2体积比较两种酸的电离程度:醋酸<盐酸 |
| C、将1mLKSCN溶液与1mL同浓度FeCl3溶液充分混合;再继续加入KSCN溶液,溶液颜色加深.证明溶液中存在平衡:Fe3++3SCN-═Fe(SCN)3 |
| D、在中和热测定的实验中,将NaOH溶液和盐酸混合反应后的冷却温度作为终点温度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com