
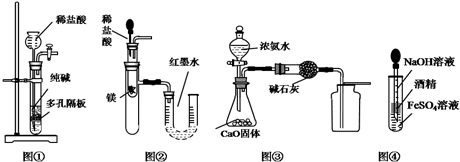
| A. | 用图①所示装置制取少量纯净的CO2气体 | |
| B. | 用图②所示装置验证镁和盐酸反应的热效应 | |
| C. | 用图③所示装置制取并收集干燥纯净的NH3 | |
| D. | 用图④装置制备Fe(OH)2并能保证较长时间观察到白色 |
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:选择题
| 操作和现象 | 结 论 | |
| A | 向盛有2mL0.1mol/LAgNO3溶液的试管中,先滴几滴0.1mol/LKCl溶液,再滴加0.1mol/LKI溶液.试管中先出现白色沉淀,后出现淡黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
| B | 向装有Fe(NO3)2溶液的试管中加入几滴稀H2SO4溶液颜色基本不变 | Fe(NO3)2与H2SO4不反应 |
| C | 在分液漏斗中加入碘水后再加入CCl4,充分振荡,分层,下层溶液呈紫色 | CCl4可作为碘的萃取剂 |
| D | 测定饱和NaClO溶液、CH3COONa溶液的pH,pH(NaClO)>pH(CH3COONa) | 弱酸的酸性:HClO<CH3COOH |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中,K+、Ca2+、Cl2、Br -可以大量共存 | |
| B. | 与足量Ca( OH)2溶液反应的离子方程式:Ca2++OH-+HS03═CaS03↓+H20 | |
| C. | 与FeCI3溶液反应的离子方程式:SO32-+2 Fe3++H20═SO42-+2Fe2++2H+ | |
| D. | 能使含I2的淀粉溶液蓝色褪去,说明NaHSO3溶液具有漂白性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W分子中碳、氢质量比为1:2 | B. | W同分异构体有5种 | ||
| C. | 经红外光谱测定W最多有4个甲基 | D. | 在核磁共振氢谱中W最少有2个峰 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
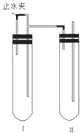 用下面两种方法可以制得白色的Fe(OH)2沉淀.
用下面两种方法可以制得白色的Fe(OH)2沉淀.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通常元素的化合价与其原子的质量数有密切的关系 | |
| B. | 已知铱的一种核素是${\;}_{77}^{191}$Ir,则其核内的中子数是114 | |
| C. | ${\;}_{6}^{14}$C和${\;}_{7}^{17}$N的质量数相同,但质子数不同,所以互称为同位素 | |
| D. | 钾的原子结构示意图为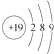 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com