
【题目】向某密闭容器中充入0.3molA、0.1molC和一定量的B三种气体。一定条件下发生反应,各物质的浓度随时间变化如甲图所示[t0~t1阶段的c(B)变化未画出]。乙图为t2时刻后改变条件时平衡体系中正、逆反应速率随时间变化的情况,且四个阶段都各改变一种反应条件且互不相同,t3~t4阶段为使用催化剂。下列说法中不正确的是

A.若t1=15s,则用A的浓度变化表示的t0~t1阶段的平均反应速率为0.006mol·L-1·s-1
B.t4~t5阶段改变的条件一定为减小压强
C.该容器的容积为2L,B的起始物质的量为0.02mol
D.该反应的化学方程式为3A![]() B+2C
B+2C
【答案】C
【解析】
A.若t1=15s,A在t0~t1时间段的平均反应速率v=![]() =
=![]() =0.006molL-1s-1,选项A正确;
=0.006molL-1s-1,选项A正确;
B.如t4~t5阶段改变的条件为降低反应温度,平衡移动发生移动,则正逆反应速率不相等,应为降低压强,选项B正确;
C.反应中A的浓度变化为0.15mol/L-0.06mol/L=0.09mol/L,C的浓度变化为0.11mol/L-0.05mol/L=0.06mol/L,反应中A与C的计量数之比为0.09:0.06=3:2,t3~t4阶段与t4~t5阶段正逆反应速率都相等,而t3~t4阶段为使用催化剂,则t4~t5阶段应为减小压强,则该反应中气体的化学计量数之和前后相等,则有:3A(g)B(g)+2C(g),根据方程式可知消耗0.09mol/L的A,则生成0.03mol/L的B,容器的体积为2L,生成B的物质的量为0.06mol,平衡时B的物质的量为0.1mol,所以起始时B的物质的量为0.1mol-0.06mol=0.04mol,选项C不正确;
D.根据选项C的分析可知,反应的方程式为3A(g)B(g)+2C(g),选项D正确;
答案选C。


科目:高中化学 来源: 题型:
【题目】下列溶液中微粒的物质的量浓度关系正确的是( )
A.0.1mol/L的NaHC2O4溶液中存在:c(Na+) + c(H+)=c(HC2O4) + c(C2O42-) +c(OH)
B.0.1 mol/L的NaHX溶液pH为4,该溶液中:c(HX)>c(H2X)>c(X2)>c(H+)>c(OH)
C.25℃时,pH=8的CH3COONa溶液中,c(CH3COOH)约为106 mol/L
D.在0.1mol/L的 NaF溶液中:c(HF)>c(F)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出铜原子价电子排布式:______。与铜同一周期的副族元素原子中最外层电子数与铜原子的相同的元素有________(填元素符号)。
(2)第三周期第一电离能处于Al和P之间的元素有______种。
(3)某种原子的结构示意图为![]() 。则该原子的核电荷数x取值范围为______。
。则该原子的核电荷数x取值范围为______。
(4)Cr在周期表中位于_____周期___族,属于___区,价电子排布图为______
(5)ClO4-互为等电子体的分子或离子为____。
(6)Ni与CO能形成配合物Ni(CO)4,该分子中π键与σ键个数比为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列说法不正确的是( )
A. 0.1mol·L-1K2CO3溶液中:c(H+)+c(HCO3-)+2c(H2CO3)=c(OH-)
B. 已知Ksp(AgCl)>Ksp(AgBr),将AgCl和AgBr的饱和溶液等体积混合,再加入足量的浓AgNO3溶液,AgCl沉淀多于AgBr沉淀
C. 常温下,pH=4.75、浓度均为0.1mol/L 的CH3COOH、CH3COONa 混合溶液:c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+)
D. 已知Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=2.0×10-12,向浓度均为1×10-3mol/L 的KCl 和K2CrO4混合液中滴加1×10-3mol/LAgNO3溶液,Cl-先形成沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第三周期元素X、Y、Z、W的最高价氧化物溶于水可得四种溶液,0.01mol/L的这四种溶液pH与该元素原子半径的关系如图所示。下列说法正确的是
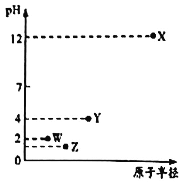
A.简单离子半径:X>Y>Z>W
B.Z与X形成的化合物的水溶液pH>7
C.气态氢化物的稳定性:Z>W>Y
D.X和Y的最高价氧化物对应的水化物恰好中和时,溶液中的微粒共有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知几种短周期元素的原子半径、常见的最高价和最低价如下表,下列说法中不正确的是( )
元素编号 | |||||||
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | |
原子半径 | 0.073 | 0.075 | 0.152 | 0.110 | 0.099 | 0.186 | 0.143 |
最高正化合价 | 无 |
|
|
|
|
|
|
最低负化合价 |
|
| 无 |
|
| 无 | 无 |
A.⑦的简单离子不是同周期元素离子半径最小的
B.①元素的氢化物有两种
C.②的气态氢化物浓溶液可用于检验氯气管道的泄漏
D.阴离子的还原性④大于⑤,最高价氧化物的水化物的碱性③小于⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器中把4molA和2molB混合,在一定条件下发生反应3A(g)+2B(g)![]() zC(g)+2D(g)。2min后反应达到平衡时生成1.6molC,又测得反应速率v(D)=0.2mol/(L·min)。则下列说法正确的是( )
zC(g)+2D(g)。2min后反应达到平衡时生成1.6molC,又测得反应速率v(D)=0.2mol/(L·min)。则下列说法正确的是( )
A.z=4
B.B物质的转化率是20%
C.A的平衡浓度是1.6mol/L
D.平衡时气体压强是原来的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中NO产生的反应为:N2(g)+O2(g)![]() 2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。下列叙述正确的是:
2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,下图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。下列叙述正确的是:

A. 温度T下,该反应的平衡常数K=![]()
B. 温度T下,随着反应的进行,混合气体的密度减小
C. 曲线b对应的条件改变可能是加入了催化剂
D. 若曲线b对应的条件改变是温度,可判断该反应的△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.用相应的方程式解释:
(1)NaHSO3溶液显酸性:___________________
(2)NaHCO3溶液显碱性:____________________
(3)NH4Cl溶液显酸性:______________________
(4)明矾[KAl(SO4)2]净水:___________________
(5)FeCl3溶液蒸干得到Fe2O3固体:____________(第一步反应)
II.向2份0.1mol/LCH3COONa溶液中分别加入少量NH4NO3、Na2CO3固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为_______、______(填“减小”、“增大”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com