
【题目】下列溶液中微粒的物质的量浓度关系正确的是( )
A.0.1mol/L的NaHC2O4溶液中存在:c(Na+) + c(H+)=c(HC2O4) + c(C2O42-) +c(OH)
B.0.1 mol/L的NaHX溶液pH为4,该溶液中:c(HX)>c(H2X)>c(X2)>c(H+)>c(OH)
C.25℃时,pH=8的CH3COONa溶液中,c(CH3COOH)约为106 mol/L
D.在0.1mol/L的 NaF溶液中:c(HF)>c(F)
【答案】C
【解析】
A. NaHC2O4溶液中遵循电荷守恒,即c(Na+) + c(H+)=c(HC2O4) + 2c(C2O42-) +c(OH),A项错误;
B. 0.1 mol/L的NaHX溶液pH为4,说明HX-的电离程度大于水解程度,因HX-的电离方程式为:HX-![]() H++X2-,水解方程式为:HX-+H2O
H++X2-,水解方程式为:HX-+H2O![]() H2X+OH-,故c(X2)>c(H2X),该溶液中:c(HX)>c(X2)>c(H2X)>c(H+)>c(OH),B项错误;
H2X+OH-,故c(X2)>c(H2X),该溶液中:c(HX)>c(X2)>c(H2X)>c(H+)>c(OH),B项错误;
C. CH3COONa溶液中遵循质子守恒定律,即c(OH)=c(H+)+c(CH3COOH),因溶液的pH=8,故c(H+)=10-8mol/L,c(OH)=![]() =10-6mol/L,故c(CH3COOH)=10-6mol/L-10-8mol/L
=10-6mol/L,故c(CH3COOH)=10-6mol/L-10-8mol/L![]() 106 mol/L,C项正确;
106 mol/L,C项正确;
D. 在0.1mol/L的NaF溶液中,氟离子会发生水解,其水解方程式为:F-+H2O![]() HF+OH-,因水解比较微弱,故c(F)>c(HF),D项错误;
HF+OH-,因水解比较微弱,故c(F)>c(HF),D项错误;
答案选C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】环之间共用一个碳原子的化合物称为螺环化合物,螺[2,2]戊烷(![]() )是最简单的一种。下列关于该化合物的说法不正确的是
)是最简单的一种。下列关于该化合物的说法不正确的是
A. 与环戊烯互为同分异构体
B. 二氯代物超过四种(不考虑空间异构)
C. 所有碳原子均处同一平面
D. 由该物质生成1 mol C5H12需要2 mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K时,将20mL3xmol·L-1Na3AsO3、20mL3xmol·L-1I2和20mLNaOH溶液混合,发生反应:AsO33-(aq)+I2(aq)+2OH-(aq)![]() AsO43-(aq)+2I-(aq)+H2O(l),溶液中c(AsO43- 与反应时间(t)的关系如图所示。下列不能判断反应达到平衡的是
AsO43-(aq)+2I-(aq)+H2O(l),溶液中c(AsO43- 与反应时间(t)的关系如图所示。下列不能判断反应达到平衡的是
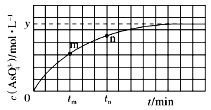
A. 溶液的pH不再变化
B. 2v正(I-)=v逆(AsO33-)
C. c(AsO43-)/c(AsO33-)不再变化
D. c(I-)=2ymol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是25 ℃时某些盐的溶度积常数和弱酸的电离平衡常数,下列说法正确的是
化学式 | AgCl | Ag2CrO4 | CH3COOH | HClO | H2CO3 |
Ksp或Ka | Ksp=1.8×10-10 | Ksp=9.0×10-12 | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
A. H2CO3、HCO3-、CH3COO-、ClO- 在溶液中可以大量共存
B. 等体积等浓度的CH3COONa和NaClO中离子总数:CH3COONa <NaClO
C. 向浓度均为1.0×10-3 mol·L-1的KCl和K2CrO4混合溶液中滴加1.0×10-3 mol·L-1的AgNO3溶液,CrO42―先形成沉淀
D. 向0.1 mol·L-1 CH3COOH溶液中滴加NaOH溶液中至c(CH3COOH):c(CH3COO-)=5∶9,此时溶液的pH=5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.实验室选用酸性KMnO4溶液与H2C2O4溶液反应来探究影响化学反应速率的因素:
实验前先用酸性KMnO4标准溶液滴定未知浓度的草酸
(1)配平反应原理离子方程式:
___MnO4-+ __H2C2O4+___→___Mn2++ ___CO2↑+____H2O
(2)探究影响化学反应速率的因素
实验 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度 | ||
浓度/mol·L-1 | 体积/mL | 浓度/mol·L-1 | 体积/mL | ||
① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
a.探究温度对化学反应速率影响的实验编号是_______(填编号,下同),探究反应物浓度对化学反应速率影响的实验编号是_______。
b.混合液褪色时间由大到小的顺序是_____________。
c.测得某次实验(恒温)时溶液中Mn2+物质的量与时间关系如图所示,请解释“n(Mn2+)在反应起始时变化不大,一段时间后快速增大”的主要原因:_______。

Ⅱ. 用酸性KMnO4溶液滴定含杂质的Na2C2O4样品(已知杂质不与KMnO4和H2SO4溶液反应)。
实验步骤:准确取1 g Na2C2O4样品,配成
(3)高锰酸钾溶液应装在____滴定管中。(填“酸式”或“碱式”)
(4)滴定至终点时的实验现象是:_________。
(5)计算样品中Na2C2O4的纯度是______%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将浓度均为0.1mol/L。体积分别为![]() 和
和![]() 的HA溶液与BOH溶液按不同体积比混合,保持
的HA溶液与BOH溶液按不同体积比混合,保持![]() +
+![]() =100mL,
=100mL,![]() 、
、![]() 与混合溶液的pH的关系如图所示。下列说法正确的是( )
与混合溶液的pH的关系如图所示。下列说法正确的是( )
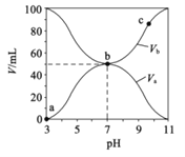
A.a→b过程中水的电离程度始终增大
B.![]() mol/L1
mol/L1
C.b点时,c(B-)=c(A-)=c(OH-)=c(H+)
D.由图可知BOH一定是强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M是降低润滑油凝固点的高分子有机化合物,其结构简式为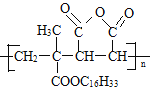 ,用石油裂解气合成M的路线图如图:
,用石油裂解气合成M的路线图如图:
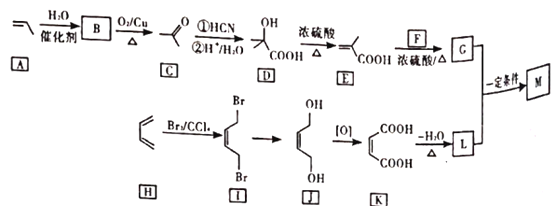
回答下列问题:
(1)B的化学名称为______。
(2)F的分子式为_____。
(3)G中官能团的名称是_____,G与L在一定条件下生成M的反应类型为____。
(4)I→J的反应方程式为_____。
(5)写出2种符合条件的C的同分异构体的结构简式____。(核磁共振氢谱为三组峰,峰面积比为3:2:1;已知双键和羟基相连时物质不稳定)
(6)设计由苯乙烯为起始原料制备![]() 的合成路线(无机试剂任选)____。
的合成路线(无机试剂任选)____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,向A、B中均充入1mol X、lmol Y,起始时A、B的体积都等于a L,在相同温度、外界压强和催化剂存在的条件下,关闭活塞K,使两容器中都发生下述反应: X(g)+Y(g)![]() 2Z(g)+W(g) △H<0。达平衡时,A的体积为1.4a L。下列说法错误的是( )
2Z(g)+W(g) △H<0。达平衡时,A的体积为1.4a L。下列说法错误的是( )
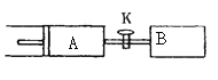
A.反应速率:![]()
B.平衡时的压强:![]()
![]()
C.A容器中X的转化率为80%
D.平衡时Y体积分数:A<B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某密闭容器中充入0.3molA、0.1molC和一定量的B三种气体。一定条件下发生反应,各物质的浓度随时间变化如甲图所示[t0~t1阶段的c(B)变化未画出]。乙图为t2时刻后改变条件时平衡体系中正、逆反应速率随时间变化的情况,且四个阶段都各改变一种反应条件且互不相同,t3~t4阶段为使用催化剂。下列说法中不正确的是

A.若t1=15s,则用A的浓度变化表示的t0~t1阶段的平均反应速率为0.006mol·L-1·s-1
B.t4~t5阶段改变的条件一定为减小压强
C.该容器的容积为2L,B的起始物质的量为0.02mol
D.该反应的化学方程式为3A![]() B+2C
B+2C
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com