
����Ŀ��������25 ��ʱijЩ�ε��ܶȻ�����������ĵ���ƽ�ⳣ��������˵����ȷ����
��ѧʽ | AgCl | Ag2CrO4 | CH3COOH | HClO | H2CO3 |
Ksp��Ka | Ksp=1.8��10��10 | Ksp=9.0��10��12 | Ka=1.8��10��5 | Ka=3.0��10��8 | Ka1=4.1��10��7 Ka2=5.6��10��11 |
A. H2CO3��HCO3����CH3COO����ClO�� ����Һ�п��Դ�������
B. �������Ũ�ȵ�CH3COONa��NaClO������������CH3COONa ��NaClO
C. ��Ũ�Ⱦ�Ϊ1.0��10��3 mol��L��1��KCl��K2CrO4�����Һ�еμ�1.0��10��3 mol��L��1��AgNO3��Һ��CrO42�D���γɳ���
D. ��0.1 mol��L��1 CH3COOH��Һ�еμ�NaOH��Һ����c(CH3COOH):c(CH3COO��)��5��9����ʱ��Һ��pH=5
���𰸡�D
��������
A.����H2CO3��Ka1����HClO��Ka������ǿ��������ԭ��H2CO3+ClO��=HCO3-+HClO�� H2CO3��ClO������Һ�в����Դ������棬��A����
B. ��Ũ�Ⱦ�Ϊ��0.1mol/L��NaClO��Һ�е�c��Na+��=0.1mol/L������Һ�еĵ���غ��У�c��Na+��+c��H+��=c��ClO-��+c��OH-����CH3COONa��Һ�е�c��Na+��=0.1mol/L����Һ�еĵ���غ��У�c��Na+��+c��H+��=c��CH3COO-��+c��OH-��������Һ�е�c��Na+����ͬ����ˮ��̶Ȳ�ͬ���������Ƶ�ˮ��̶ȴ����Դ������������ӵ�Ũ�ȴ��ڴ������ƣ����У�c��ClO-��+c��OH-����c��CH3COO-��+c��OH-������������������NaClO��Һ��CH3COONa��Һ����B����
C. AgCl��������C(Ag+)=![]() =1.8��10��10/(1.0��10��3)=1.8��10��7mol/L, Ag2CrO4��������C(Ag+)=
=1.8��10��10/(1.0��10��3)=1.8��10��7mol/L, Ag2CrO4��������C(Ag+)=![]() =
=![]() =3��10-4.5 mol/L�������������ȳ�������C����
=3��10-4.5 mol/L�������������ȳ�������C����
D. c(CH3COOH):c(CH3COO��)��5��9�����ݴ���ĵ��볣��Ka=1.8��10��5=![]() =
=![]() ��C(H+)=10-5,��ʱ��Һ��pH=5,��D��ȷ��
��C(H+)=10-5,��ʱ��Һ��pH=5,��D��ȷ��
��ȷ�𰸣�D��


 �����Ծ���Ԫ���Ծ�ϵ�д�
�����Ծ���Ԫ���Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ž��з���Ԫ��������150���ꡣ�����Ԫ�����ڱ���һ���֣�W��X��Y��ZΪ����������Ԫ�أ�W��X������ϼ�֮��Ϊ7������˵��������ǣ� ��
![]()
A. W���ʵ��۵�һ������Y����
B. X �����Ӱ뾶��ͬ����Ԫ�ؼ����Ӱ뾶����С
C. ���������ˮ�������ԣ�W��X
D. ����̬�⻯�����ȶ��ԣ�Z��Y
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�������
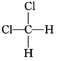
��O2��O3 ��H2��D2��T2 ��12C��14C ��CH3CH2CH2CH3��(CH3)2CHCH3 ������Ͷ��� ��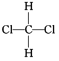 ��
�� ��
��![]() ��
��![]() ����������ˮ ����Ͱ���
����������ˮ ����Ͱ���
��Ϊͬλ�ص���___(����ţ���ͬ)����Ϊͬ�����������___����Ϊͬϵ�����__����Ϊͬ���칹�����__������ͬһ���ʵ���__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵�����ʾ������ȷ���ǣ� ��
A.�����������������������ֱ���ȫȼ�գ����߷ų���������
B.��C��ʯī����C�����ʯ����H=+1.9kJ��mol-1��֪�����ʯ��ʯī�ȶ�
C.��ϡ��Һ�У�H+��aq��+OH-��aq��=H2O��l����H=-57.3kJ��mol-1��������0.5molH2SO4��Ũ�����뺬1molNaOH����Һ��ϣ��ų�����������57.3kJ
D.��101kPaʱ��2gH2��ȫȼ������Һ̬ˮ���ų�285.8kJ����������ȼ�յ��Ȼ�ѧ����ʽΪ��2H2��g��+O2��g��=2H2O��l����H=-285.8kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���������İ��������(NH2COONH4)�������Ƶ��ܱ����������(��������������䣬��������������Բ���)���ں㶨�¶���ʹ��ﵽ�ֽ�ƽ�⣺NH2COONH4(s)![]() 2NH3(g)+CO2(g)��
2NH3(g)+CO2(g)��
��1�����в����жϸ÷ֽⷴӦ�Ѿ��ﵽ��ѧƽ��״̬����___(��ѡ��)��
A.2v��(NH3)=v��(CO2)
B.�ܱ������а��������ʵ�������
C.������CO2��NH3�����ʵ���֮�ȱ��ֲ���
D.�ܱ���������ѹǿ���ֲ���
E.�γ�6��N-H����ͬʱ��2��C=O������
��2����ʹ�÷�Ӧ�ķ�Ӧ�����������___(��ѡ��);
A.��ʱ�����CO2����
B.�ʵ������¶�
C.��������NH2COONH4(s)
D.ѡ���Ч����
��3����ͼ��ʾ��������Ӧ�жϿ���Ӧ���л�ѧ�����յ�����___�γ��������л�ѧ���ų�������(��д������������������С����)��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼװ�ã�����һ�ֿɳ���أ�װ�ã���Ϊ���ء�

װ�ã������ӽ���Ĥֻ����Na+ͨ������֪��س�ŵ�Ļ�ѧ����ʽΪ2Na2S2+NaBr3����![]() Na2S4+3NaBr�����պϿ���Kʱ��X�缫������Һ��졣����˵����ȷ����
Na2S4+3NaBr�����պϿ���Kʱ��X�缫������Һ��졣����˵����ȷ����
A. �պϿ���Kʱ�������Ӵ��ҵ���ͨ�����ӽ���Ĥ
B. �պϿ���Kʱ��������ӦʽΪ��3NaBr-2e-=NaBr3+2Na+
C. �պϿ���Kʱ��X�缫��ӦʽΪ��2Cl--2e-=Cl2��
D. �պϿ���Kʱ������0.1molNa+ͨ�����ӽ���Ĥ��X�缫��������״��������1.12L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1���ڢ�CO2����NaCl����Na����Si����CS2�����ʯ���ߣ�NH4��2SO4�����Ҵ��У��ɼ��Լ��γɵķǼ��Է�����_______������ţ�����ͬ�������н������ӵ�������__�����Ӽ���γ������������________���������Ӿ������__������ԭ�Ӿ������__���١����������ʵ��۵��ɸߵ��͵�˳����__��
��2��A��B��C��DΪ���־��壬�������£�
A����̬ʱ�ܵ��磬����������
B��������CS2��������ˮ
C����̬ʱ�����磬Һ̬ʱ�ܵ��磬������ˮ
D����̬��Һ̬ʱ�������磬�۵�Ϊ3500 ��
���ƶ����ǵľ������ͣ�A��__��B��__��C��__��D��__��
��3����ͼ��A��D����ѧ��ѧ�̿����ϳ����ļ��־���ṹģ�ͣ�����д��Ӧ���ʵ����ƣ�A��__��B��__��C��__D��____��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������̪�� ����һ��������Ѫ�ܼ�����ҩ�����һ�ֺϳ�·����ͼ��
����һ��������Ѫ�ܼ�����ҩ�����һ�ֺϳ�·����ͼ��

��֪��
��1��Y��������_____��
��2��H�Ľṹ��ʽΪ___��
��3��X��Y�ķ�Ӧ������_____��H�������ӵ���һ��������ָ_____��
��4��д��W��X�Ļ�ѧ����ʽ��_____��
��5��W�Ķ��������___�֣�����һ���ں˴Ź�����������3���ĽṹΪ___(��ṹ��ʽ)��
��6����ijϩ��Ϊԭ�Ϻϳ�(CH3)3CMgBr�������������̣���ƺϳ�·�ߡ�___
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£���Ũ�ȶ���0.1mol��L-1��X2��Y2��������������ܱ������У�ʹ֮������Ӧ��������Z���ﵽƽ��ʱc(X2)=0.04mol��L-1��c(Y2)=0.08mol��L-1��c(Z)=0.04mol��L-1����÷�Ӧ�ķ�Ӧʽ��
A. X2+2Y2![]() XY2 B. 3X2+Y2
XY2 B. 3X2+Y2![]() 2X3Y
2X3Y
C. 2X2+Y2![]() 2X2Y D. X2+3Y2
2X2Y D. X2+3Y2![]() 2XY3
2XY3
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com