
【题目】25℃时,将浓度均为0.1mol/L。体积分别为![]() 和
和![]() 的HA溶液与BOH溶液按不同体积比混合,保持
的HA溶液与BOH溶液按不同体积比混合,保持![]() +
+![]() =100mL,
=100mL,![]() 、
、![]() 与混合溶液的pH的关系如图所示。下列说法正确的是( )
与混合溶液的pH的关系如图所示。下列说法正确的是( )
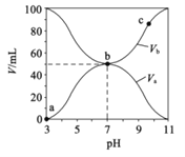
A.a→b过程中水的电离程度始终增大
B.![]() mol/L1
mol/L1
C.b点时,c(B-)=c(A-)=c(OH-)=c(H+)
D.由图可知BOH一定是强碱
【答案】A
【解析】
A. HA是弱酸,酸电离产生H+对水的电离平衡起抑制作用,在a→b过程中,酸被碱中和,溶液中酸电离产生的c(H+)减小,其对水的电离的抑制作用减弱,故水的电离程度始终增大,A项正确;
B. Ka(HA)=![]() mol/L,B项错误;
mol/L,B项错误;
C. b点是两者等体积混合溶液呈中性,c(B-)=c(A-),c(OH-)=c(H+),盐电离产生离子浓度远大于水电离产生的离子浓度,故离子浓度的大小为:c(B-)=c(A-)>c(OH-)=c(H+),C项错误;
D. 根据图知,酸溶液的pH=3,则c(H+)<0.1mol/L,说明HA是弱酸;碱溶液的pH=11,c(OH-)<0.1mol/L,则BOH是弱碱,D项错误;
答案选A。


科目:高中化学 来源: 题型:
【题目】肉桂酸异戊酯G( )是一种香料,一种合成路线如下:
)是一种香料,一种合成路线如下:

已知以下信息:
①RCHO+![]()
![]()
 +H2O
+H2O
②C为甲醛的同系物,相同条件下其蒸气与氢气的密度比为22。
回答下列问题:
(1)A转化为B的化学方程式为________。
(2)B和C反应生成D的化学方程式为________。
(3)F的结构简式为________,名称为________。
(4)D与新制Cu(OH)2悬浊液反应的化学方程式为________。
(5)F的同分异构体中不能与金属钠反应生成氢气、核磁共振氢谱只有两组峰、且峰面积比为3∶1的为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学拟用A、C两种有机物合成F(苯乙酸乙酯),合成的路线如图所示:
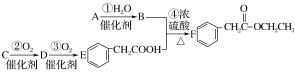
已知:A为最简单的烯烃,C为烃的衍生物,D中含有—CHO。
(1)请写出C的结构简式:________________。
(2)请写出①④的反应类型:①_______________④______________。
(3)请分别写出C、E中官能团的名称:C___________E__________。
(4)写出反应②④的化学方程式:
②__________;
④_________。
(5)J是有机物A的同系物,且比A多1个碳原子,J的加聚产物的结构简式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.(1)将Mg条放入浓NH4Cl溶液中产生氢气,请用离子方程式解释该现象产生的原因__________。
(2)Mg(OH)2浊液中存在Mg(OH)2的沉淀溶解平衡,可表示为(用离子方程式表示)_______,若向此浊液中加入浓的NH4Cl溶液,观察到的现象是________。
Ⅱ.盐酸、醋酸和碳酸是化学实验和研究中常用的几种酸。
已知室温下:Ka(CH3COOH)=1.7×10-5;H2CO3的电离常数Ka1=4.2×10-7、Ka2=5.6×10-11
(1)①用离子方程式解释碳酸氢钠水溶液显碱性的原因______________。
②常温下,物质的量浓度相同的下列四种溶液:
a.碳酸钠溶液 b.醋酸钠溶液 c.氢氧化钠溶液 d.氢氧化钡溶液,
其pH由大到小的顺序是_______________(填序号)。
(2)某温度下,将pH均为4的盐酸和醋酸溶液分别加水稀释,其pH随溶液体积变化的曲线图中a、b、c三点对应溶液中水的电离程度由大到小的顺序为_________。

(3)在t℃时,某NaOH稀溶液中c(H+)=10-amol·L-1,c(OH-)=10-bmol·L-1,已知a+b=12,则在该温度下,将100mL 0.1 mol·L-1的稀H2SO4与100mL 0.4 mol·L-1的NaOH溶液混合后,溶液pH=______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中微粒的物质的量浓度关系正确的是( )
A.0.1mol/L的NaHC2O4溶液中存在:c(Na+) + c(H+)=c(HC2O4) + c(C2O42-) +c(OH)
B.0.1 mol/L的NaHX溶液pH为4,该溶液中:c(HX)>c(H2X)>c(X2)>c(H+)>c(OH)
C.25℃时,pH=8的CH3COONa溶液中,c(CH3COOH)约为106 mol/L
D.在0.1mol/L的 NaF溶液中:c(HF)>c(F)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E四种短周期元素的原子序数逐渐增大。A为非金属元素,且A、E同主族,C、D为同周期的相邻元素。E原子的质子数等于C、D原子最外层电子数之和。B原子最外层电子数是内层电子数的2倍。C的氢化物分子中有3个共价键,试推断:
(1)写出B元素在周期表中的位置____________________;
(2)由A、C、D所形成的离子化合物是_______________(填化学式),所含化学键类型为_____________,它与E的最高价氧化物对应水化物的溶液加热时反应的离子方程式是___________________________。
(3) C单质的电子式为____________________。
(4) B和D相比,非金属性较强的是_________________(用元素符号表示),下列事实能证明这一结论的是________________(选填字母序号)。
a.常温下,B的单质呈固态,D的单质呈气态 b.D的氢化物的稳定性强于B的氢化物
c.B与D形成的化合物中,B呈正价 d.D的氢化物的沸点高于B的氢化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要用480mL0.1molL-1的硫酸铜溶液,以下配制方法正确的是( )
A. 称取![]() 胆矾(CuSO4·5H2O),配成500mL溶液
胆矾(CuSO4·5H2O),配成500mL溶液
B. 称取![]() 胆矾(CuSO4·5H2O),加入500mL水配成溶液
胆矾(CuSO4·5H2O),加入500mL水配成溶液
C. 称取![]() 无水硫酸铜粉末,加入480mL水配成溶液
无水硫酸铜粉末,加入480mL水配成溶液
D. 称取![]() 无水硫酸铜粉末,加入500mL水配成溶液
无水硫酸铜粉末,加入500mL水配成溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物有许多用途,相关物质的物理常数如下表所示:
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
熔点/℃ | 85.5 | 115.2 | >600(分解) | 75.5 | 16.8 | 10.3 |
沸点/℃ | 60.3 | 444.6 | 10.0 | 45.0 | 337.0 |
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为__________,基态S原子电子占据最高能级的电子云轮廓图为_________形。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是_________。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为__________。

(4)气态三氧化硫以单分子形式存在,其分子的立体构型为_____形,其中共价键的类型有______种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为________。
(5)FeS2晶体的晶胞如图(c)所示。晶胞边长为a nm、FeS2相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为___________g·cm3;晶胞中Fe2+位于![]() 所形成的正八面体的体心,该正八面体的边长为______nm。
所形成的正八面体的体心,该正八面体的边长为______nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知几种短周期元素的原子半径、常见的最高价和最低价如下表,下列说法中不正确的是( )
元素编号 | |||||||
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | |
原子半径 | 0.073 | 0.075 | 0.152 | 0.110 | 0.099 | 0.186 | 0.143 |
最高正化合价 | 无 |
|
|
|
|
|
|
最低负化合价 |
|
| 无 |
|
| 无 | 无 |
A.⑦的简单离子不是同周期元素离子半径最小的
B.①元素的氢化物有两种
C.②的气态氢化物浓溶液可用于检验氯气管道的泄漏
D.阴离子的还原性④大于⑤,最高价氧化物的水化物的碱性③小于⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com