
【题目】Ⅰ.(1)将Mg条放入浓NH4Cl溶液中产生氢气,请用离子方程式解释该现象产生的原因__________。
(2)Mg(OH)2浊液中存在Mg(OH)2的沉淀溶解平衡,可表示为(用离子方程式表示)_______,若向此浊液中加入浓的NH4Cl溶液,观察到的现象是________。
Ⅱ.盐酸、醋酸和碳酸是化学实验和研究中常用的几种酸。
已知室温下:Ka(CH3COOH)=1.7×10-5;H2CO3的电离常数Ka1=4.2×10-7、Ka2=5.6×10-11
(1)①用离子方程式解释碳酸氢钠水溶液显碱性的原因______________。
②常温下,物质的量浓度相同的下列四种溶液:
a.碳酸钠溶液 b.醋酸钠溶液 c.氢氧化钠溶液 d.氢氧化钡溶液,
其pH由大到小的顺序是_______________(填序号)。
(2)某温度下,将pH均为4的盐酸和醋酸溶液分别加水稀释,其pH随溶液体积变化的曲线图中a、b、c三点对应溶液中水的电离程度由大到小的顺序为_________。

(3)在t℃时,某NaOH稀溶液中c(H+)=10-amol·L-1,c(OH-)=10-bmol·L-1,已知a+b=12,则在该温度下,将100mL 0.1 mol·L-1的稀H2SO4与100mL 0.4 mol·L-1的NaOH溶液混合后,溶液pH=______。
【答案】NH4++H2O![]() NH3·H2O+H+、Mg+2H+=Mg2++H2↑或合并写 Mg(OH)2(s)
NH3·H2O+H+、Mg+2H+=Mg2++H2↑或合并写 Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq) 沉淀溶解,溶液澄清 HCO3-+H2O
Mg2+(aq)+2OH-(aq) 沉淀溶解,溶液澄清 HCO3-+H2O![]() H2CO3+OH- d c a b b=c>a 11
H2CO3+OH- d c a b b=c>a 11
【解析】
Ⅰ.(1)NH4Cl水解,溶液呈酸性,镁条与氢离子反应放出氢气;
(2)Mg(OH)2浊液中存在Mg(OH)2的沉淀溶解平衡,加入浓的NH4Cl溶液,铵根离子结合氢氧化镁电离出的氢氧根离子生成一水合氨,促进Mg(OH)2的沉淀溶解平衡正向移动。
Ⅱ. (1)①碳酸氢钠中碳酸氢根离子水解程度大于电离程度而导致其溶液呈碱性;
②氢氧根离子浓度越大,溶液的pH越大,水解程度大的阴离子对应的碱性越强,据此回答;
(2)酸抑制水电离,酸电离出的氢离子浓度越大,对水电离的抑制作用越强;
(3)在t℃时,某NaOH稀溶液中c(H+)=10-amol·L-1,c(OH-)=10-bmol·L-1,已知a+b=12,Kw= c(H+)×c(OH-),则在该温度下Kw=10-12。
Ⅰ.(1)NH4Cl水解,溶液呈酸性,将Mg条放入浓NH4Cl溶液中,镁条与氢离子反应放出氢气,反应离子方程式是NH4++H2O![]() NH3·H2O+H+、Mg+2H+=Mg2++H2↑;
NH3·H2O+H+、Mg+2H+=Mg2++H2↑;
(2)Mg(OH)2浊液中存在Mg(OH)2的沉淀溶解平衡,Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq),若向此浊液中加入浓的NH4Cl溶液,铵根离子结合氢氧化镁电离出的氢氧根离子生成一水合氨,促进Mg(OH)2的沉淀溶解平衡正向移动,Mg(OH)2固体溶解,所以观察到的现象是沉淀溶解,溶液澄清;
Mg2+(aq)+2OH-(aq),若向此浊液中加入浓的NH4Cl溶液,铵根离子结合氢氧化镁电离出的氢氧根离子生成一水合氨,促进Mg(OH)2的沉淀溶解平衡正向移动,Mg(OH)2固体溶解,所以观察到的现象是沉淀溶解,溶液澄清;
Ⅱ.(1)碳酸氢钠中碳酸氢根离子水解程度大于电离程度而导致其溶液呈碱性,碳酸氢根离子水解方程式为:HCO3-+H2O![]() H2CO3+OH-;
H2CO3+OH-;
②物质的量浓度相同的四种溶液,c、d是强碱,氢氧化钡中氢氧根离子浓度大,所以pH大,ab中阴离子水解,导致溶液显示碱性,醋酸钠根离子的水解程度小于碳酸根离子,所以碳酸钠的碱性强于醋酸钠,即pH由大到小的顺序是:dcab;
(2)酸抑制水电离,酸电离出的氢离子浓度越大,对水电离的抑制作用越强,a点的pH最小,酸性最强,水电离程度最小,b、c点的pH相等,水电离程度相同,所以a、b、c三点对应溶液中水的电离程度由大到小的顺序为b=c>a;
(3)在t℃时,将100mL 0.1 mol·L-1的稀H2SO4与100mL 0.4 mol·L-1的NaOH溶液混合,氢氧化钠过量,c(OH-)=![]() 0.1 mol·L-1,在t℃时Kw=10-12,c(H+)=10-amol·L-11,pH=11。
0.1 mol·L-1,在t℃时Kw=10-12,c(H+)=10-amol·L-11,pH=11。


科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究,其结构简式如图。下列关于分枝酸的叙述正确的是

A. 分子中含有3种官能团
B. 分枝酸的分子式为C10H10O6
C. 1mol分枝酸最多可与3molNaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美托洛尔可用于治疗高血压及心绞痛,某合成路线如下:
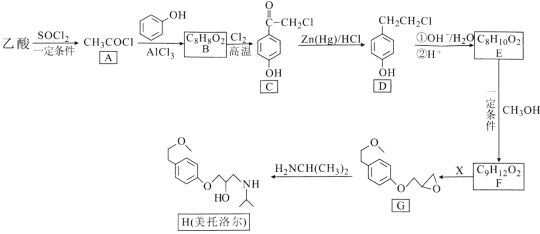
回答下列问题:
(1)美托洛尔分子中含氧官能团的名称是_____。
(2)A→B的反应类型是____,G的分子式为____。
(3)反应E→F的化学方程式为_______。
(4)试剂X的分子式为C3H5OCl,则X的结构简式为____。
(5)B的同分异构体中,含有苯环且能发生水解反应的共有____种,其中苯环上只有一个取代基且能发生银镜反应的结构简式为_____。
(6)4-苄基苯酚(![]() )是一种药物中间体,请设计以苯甲酸和苯酚为原料制备4-苄基苯酚的合成路线:__________(无机试剂任用)。
)是一种药物中间体,请设计以苯甲酸和苯酚为原料制备4-苄基苯酚的合成路线:__________(无机试剂任用)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,反应:6H2 + 2CO2![]() C2H5OH + 3H2O的数据如下图所示。
C2H5OH + 3H2O的数据如下图所示。


下列说法正确的是
A.该反应的△H > 0
B.达平衡时,v(H2)正 = v(CO2)逆
C.b点对应的平衡常数K值大于c点
D.a点对应的H2的平衡转化率为90 %
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是25 ℃时某些盐的溶度积常数和弱酸的电离平衡常数,下列说法正确的是
化学式 | AgCl | Ag2CrO4 | CH3COOH | HClO | H2CO3 |
Ksp或Ka | Ksp=1.8×10-10 | Ksp=9.0×10-12 | Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.1×10-7 Ka2=5.6×10-11 |
A. H2CO3、HCO3-、CH3COO-、ClO- 在溶液中可以大量共存
B. 等体积等浓度的CH3COONa和NaClO中离子总数:CH3COONa <NaClO
C. 向浓度均为1.0×10-3 mol·L-1的KCl和K2CrO4混合溶液中滴加1.0×10-3 mol·L-1的AgNO3溶液,CrO42―先形成沉淀
D. 向0.1 mol·L-1 CH3COOH溶液中滴加NaOH溶液中至c(CH3COOH):c(CH3COO-)=5∶9,此时溶液的pH=5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某课外活动小组用如图装置进行实验,试回答下列问题:
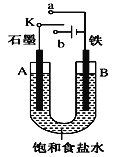
①若开始时开关K与a连接,则A极的电极反应式为____B极的Fe发生_____腐蚀(填“析氢”或“吸氧”)
②若开始时开关K与b连接,则装置内总反应的离子方程式为______;根据此时的装置,判断下列说法正确的是_____(填序号)
a. 溶液中Na+向A极移动
b. 从A极处逸出的气体能使湿润的KI淀粉试纸变蓝
c. 反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
d. 若标准状况下B极产生2.24L气体,则溶液中转移0.2mol电子
(2)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料。如LiFePO4电池中某电极的工作原理如下图所示:
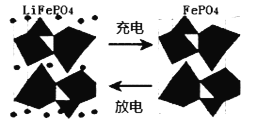
①已知该电池的电解质为能传导Li+的固体材料。放电时该电极是电池的_____极(填“正”或“负”),该电极反应式为_____。
②用此电池电解含有0.1mol/LCuSO4和0.1mol/LNaCl的混合溶液100mL,假如电路中转移了0.02mole-,且电解池的电极均为惰性电极,则阳极产生的气体在标准状况下的体积是_____L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将浓度均为0.1mol/L。体积分别为![]() 和
和![]() 的HA溶液与BOH溶液按不同体积比混合,保持
的HA溶液与BOH溶液按不同体积比混合,保持![]() +
+![]() =100mL,
=100mL,![]() 、
、![]() 与混合溶液的pH的关系如图所示。下列说法正确的是( )
与混合溶液的pH的关系如图所示。下列说法正确的是( )
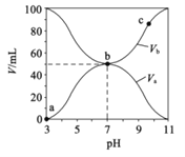
A.a→b过程中水的电离程度始终增大
B.![]() mol/L1
mol/L1
C.b点时,c(B-)=c(A-)=c(OH-)=c(H+)
D.由图可知BOH一定是强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为锌铜原电池示意图,下列说法错误的是( )
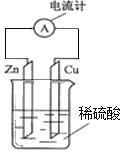
A.锌片为负极,且锌片逐渐溶解
B.电子由锌片通过导线流向铜片
C.铜为正极,铜不易失电子而受到保护
D.溶液中阳离子向![]() 极移动,且
极移动,且![]() 极上发生的是氧化反应
极上发生的是氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
A. B.
B.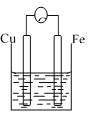 C.
C.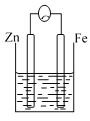
(1)A中反应的离子方程式为_________________。
(2)B中作正极的金属是____________,该电极上看到的现象为_______________。
(3)C中作负极的金属是____________,该电极反应方程式为______________。
(4)现有未知金属A,将A与Fe用导线相连后放入稀硫酸溶液中,观察到A上有气泡,在A上发______反应。(填“氧化”或“还原”),A与Fe的金属活动性大小顺序为A_____Fe(填“>”或“<”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com