
【题目】A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
A. B.
B.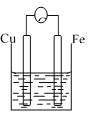 C.
C.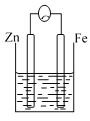
(1)A中反应的离子方程式为_________________。
(2)B中作正极的金属是____________,该电极上看到的现象为_______________。
(3)C中作负极的金属是____________,该电极反应方程式为______________。
(4)现有未知金属A,将A与Fe用导线相连后放入稀硫酸溶液中,观察到A上有气泡,在A上发______反应。(填“氧化”或“还原”),A与Fe的金属活动性大小顺序为A_____Fe(填“>”或“<”或“=”)。
【答案】Fe+2H+=Fe2++H2↑ Cu 有气泡产生 Zn Zn-2e-=Zn2+ 还原 <
【解析】
(1)如图A,装置不构成原电池装置,仅为Fe与稀硫酸的置换反应,故离子方程式为Fe+2H+=Fe2++H2↑;
(2)图B构成原电池装置,其中Fe的活动性比Cu强,故Cu为正极、Fe为负极,正极上电解质溶液中的H+得电子生成H2,现象为有气泡生成;
(3)图C构成原电池装置,其中Zn的活动性比Fe强,故Zn为负极、Fe为正极,负极的电极方程式为Zn-2e-=Zn2+;
(4)某未知金属A,将A与Fe用导线相连后放入稀硫酸溶液中,观察到A上有气泡,说明A的活动性比Fe弱,故A为正极,发生还原反应。


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.(1)将Mg条放入浓NH4Cl溶液中产生氢气,请用离子方程式解释该现象产生的原因__________。
(2)Mg(OH)2浊液中存在Mg(OH)2的沉淀溶解平衡,可表示为(用离子方程式表示)_______,若向此浊液中加入浓的NH4Cl溶液,观察到的现象是________。
Ⅱ.盐酸、醋酸和碳酸是化学实验和研究中常用的几种酸。
已知室温下:Ka(CH3COOH)=1.7×10-5;H2CO3的电离常数Ka1=4.2×10-7、Ka2=5.6×10-11
(1)①用离子方程式解释碳酸氢钠水溶液显碱性的原因______________。
②常温下,物质的量浓度相同的下列四种溶液:
a.碳酸钠溶液 b.醋酸钠溶液 c.氢氧化钠溶液 d.氢氧化钡溶液,
其pH由大到小的顺序是_______________(填序号)。
(2)某温度下,将pH均为4的盐酸和醋酸溶液分别加水稀释,其pH随溶液体积变化的曲线图中a、b、c三点对应溶液中水的电离程度由大到小的顺序为_________。

(3)在t℃时,某NaOH稀溶液中c(H+)=10-amol·L-1,c(OH-)=10-bmol·L-1,已知a+b=12,则在该温度下,将100mL 0.1 mol·L-1的稀H2SO4与100mL 0.4 mol·L-1的NaOH溶液混合后,溶液pH=______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫及其化合物有许多用途,相关物质的物理常数如下表所示:
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
熔点/℃ | 85.5 | 115.2 | >600(分解) | 75.5 | 16.8 | 10.3 |
沸点/℃ | 60.3 | 444.6 | 10.0 | 45.0 | 337.0 |
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为__________,基态S原子电子占据最高能级的电子云轮廓图为_________形。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是_________。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为__________。

(4)气态三氧化硫以单分子形式存在,其分子的立体构型为_____形,其中共价键的类型有______种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为________。
(5)FeS2晶体的晶胞如图(c)所示。晶胞边长为a nm、FeS2相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为___________g·cm3;晶胞中Fe2+位于![]() 所形成的正八面体的体心,该正八面体的边长为______nm。
所形成的正八面体的体心,该正八面体的边长为______nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.4.6gC2H5OH与6.0gCH3COOH反应,生成的CH3COOC2H3分子数目为0.1NA
B.22gCO2与标准状况下11.2LHF含有相同分子数
C.25℃时,1LpH=12的Ba(OH)2溶液中含有的OH-数目为0.02NA
D.32gO2和O3的混合物中含有的氧原子数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列说法不正确的是( )
A. 0.1mol·L-1K2CO3溶液中:c(H+)+c(HCO3-)+2c(H2CO3)=c(OH-)
B. 已知Ksp(AgCl)>Ksp(AgBr),将AgCl和AgBr的饱和溶液等体积混合,再加入足量的浓AgNO3溶液,AgCl沉淀多于AgBr沉淀
C. 常温下,pH=4.75、浓度均为0.1mol/L 的CH3COOH、CH3COONa 混合溶液:c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+)
D. 已知Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=2.0×10-12,向浓度均为1×10-3mol/L 的KCl 和K2CrO4混合液中滴加1×10-3mol/LAgNO3溶液,Cl-先形成沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员研制出一种室温“可呼吸”Na—CO2电池。放电时该电池“吸入”CO2,充电时“呼出”CO2。吸入CO2时,其工作原理如图所示。吸收的全部CO2中,有2/3转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面。下列说法正确的是

A.“吸入”CO2时,钠箔为负极
B.“吸入”CO2时的正极反应:4Na++3CO2-4e-=2Na2CO3+C
C.“呼出”CO2时,Na+向多壁碳纳米管电极移动
D.每“呼出”22.4LCO2,转移电子数为0.75mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知几种短周期元素的原子半径、常见的最高价和最低价如下表,下列说法中不正确的是( )
元素编号 | |||||||
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | |
原子半径 | 0.073 | 0.075 | 0.152 | 0.110 | 0.099 | 0.186 | 0.143 |
最高正化合价 | 无 |
|
|
|
|
|
|
最低负化合价 |
|
| 无 |
|
| 无 | 无 |
A.⑦的简单离子不是同周期元素离子半径最小的
B.①元素的氢化物有两种
C.②的气态氢化物浓溶液可用于检验氯气管道的泄漏
D.阴离子的还原性④大于⑤,最高价氧化物的水化物的碱性③小于⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中互为同分异构体的有____,互为同素异形体的 有________,互为同位素的有________,是同一种物质的有________(填序号)。
(1)液氯 (2)氯气(3)白磷(4)红磷 (5)35Cl (6)37Cl
(7)![]() (8)
(8)![]() (9)CH2=CH-CH3 (10)
(9)CH2=CH-CH3 (10)![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有100mLMgCl2和AlCl3的混合溶液,其中 c(Mg2+)=0.30mol·L-1,c(Cl-)=1.20 mol·L-1,要使Mg2+完全转化为Mg(OH)2且与Al3+恰好分开,至少需要1.00 mol·L-1的NaOH溶液的体积为
A. 80 mLB. 100 mLC. 120 mLD. 140 mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com