
【题目】我国科研人员研制出一种室温“可呼吸”Na—CO2电池。放电时该电池“吸入”CO2,充电时“呼出”CO2。吸入CO2时,其工作原理如图所示。吸收的全部CO2中,有2/3转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面。下列说法正确的是

A.“吸入”CO2时,钠箔为负极
B.“吸入”CO2时的正极反应:4Na++3CO2-4e-=2Na2CO3+C
C.“呼出”CO2时,Na+向多壁碳纳米管电极移动
D.每“呼出”22.4LCO2,转移电子数为0.75mol
 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:
【题目】(1)某课外活动小组用如图装置进行实验,试回答下列问题:
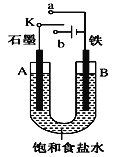
①若开始时开关K与a连接,则A极的电极反应式为____B极的Fe发生_____腐蚀(填“析氢”或“吸氧”)
②若开始时开关K与b连接,则装置内总反应的离子方程式为______;根据此时的装置,判断下列说法正确的是_____(填序号)
a. 溶液中Na+向A极移动
b. 从A极处逸出的气体能使湿润的KI淀粉试纸变蓝
c. 反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
d. 若标准状况下B极产生2.24L气体,则溶液中转移0.2mol电子
(2)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料。如LiFePO4电池中某电极的工作原理如下图所示:
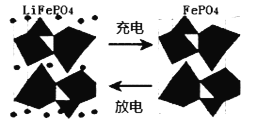
①已知该电池的电解质为能传导Li+的固体材料。放电时该电极是电池的_____极(填“正”或“负”),该电极反应式为_____。
②用此电池电解含有0.1mol/LCuSO4和0.1mol/LNaCl的混合溶液100mL,假如电路中转移了0.02mole-,且电解池的电极均为惰性电极,则阳极产生的气体在标准状况下的体积是_____L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由硫铁矿“烧渣”(主要成分:Fe3O4、Fe2O3和FeO)制备绿矾(FeSO4·7H2O))的流程如图:

已知:FeS2(S的化合价为-1)难溶于水。
(1)①中加入的酸为___,滤渣2的主要成分是___。
(2)①中生成Fe3+的离子方程式为Fe3O4+8H+=2Fe3++Fe2++4H2O、___。
(3)检验②中Fe3+已经完全转化成Fe2+的实验方法:取适量溶液2,___。
(4)通过③得到绿矾晶体的实验操作:加热浓缩、冷却结晶、___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阅读短文,回答问题。
合成氨工业结束了人类依靠天然氮肥的历史,解决了人类的粮食问题。近一百年来,工业上一直采用在高温、高压、催化剂的条件下将氮气和氢气转化为氨气,这样的条件每年需要消耗全世界1%~2%的能源供应,科学家一直致力于探索在温和条件下合成氨。中科大研究团队研制了“钌单原子催化剂”合成氨,应用该催化剂通过电化学反应在室温下即可合成氨。原理如图1所示。
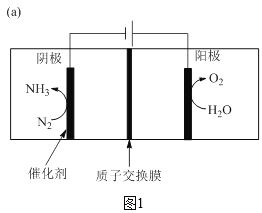
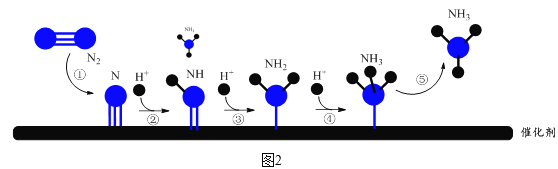
阴极表面电极反应的微观过程如图2所示。
该项研究工作开辟了单原子催化剂在电化学合成氨反应中的新途径,使得温和条件下合成氨成为可能。
请依据以上短文,判断下列说法是否正确(填“对”或“错”)。
(1)合成氨工业对解决人类的粮食问题发挥了重要作用。___
(2)传统方法合成氨的化学方程式为N2+3H2![]() 2NH3。___
2NH3。___
(3)传统合成氨的方法需消耗大量能源。___
(4)“钌单原子催化剂”合成氨体现了我国科学家在科研领域的创新。___
(5)图1中,水在阳极失去电子生成氧气。___
(6)图2中,步骤②所示反应的方程式为有N+H+NH。___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
A. B.
B.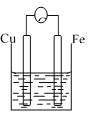 C.
C.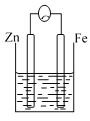
(1)A中反应的离子方程式为_________________。
(2)B中作正极的金属是____________,该电极上看到的现象为_______________。
(3)C中作负极的金属是____________,该电极反应方程式为______________。
(4)现有未知金属A,将A与Fe用导线相连后放入稀硫酸溶液中,观察到A上有气泡,在A上发______反应。(填“氧化”或“还原”),A与Fe的金属活动性大小顺序为A_____Fe(填“>”或“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲醛(微溶于水、易溶于有机溶剂,密度约等于水的密度)在碱性条件下发生歧化反应可以制备苯甲醇(在水中溶解度不大、易溶于有机溶剂,密度约等于水的密度)和苯甲酸。反应原理如下:2C6H5CHO+NaOH→C6H5CH2OH+C6H5COONa、C6H5COONa+HC1→C6H5COOH+NaC1
有关物质物理性质如表:
苯甲醛 | 苯甲醇 | 苯甲酸 | 苯 | |
沸点/℃ | 178 | 205 | 249 | 80 |
熔点/℃ | 26 | -15 | 12 | 5.5 |
苯甲酸在水中的溶解度 | ||
17℃ | 25℃ | 100℃ |
0.21g | 0.34g | 5.9g |
实验流程如图:

(1)第①步需连续加热1小时(如图1),其中加热和固定装置未画出。仪器A的名称为____,若将仪器B改为仪器C,效果不如B,说明原因____。

(2)操作②的实验名称为____。
(3)操作③用沸水浴加热蒸馏,再进行操作④(如图2),收集___℃的馏分。图2中有一处明显错误,正确的应改为____。
(4)抽滤时(如图3)烧杯中苯甲酸晶体转入布氏漏斗时,杯壁上还粘有少量晶体,用___冲洗杯壁上残留的晶体,抽滤完成后用____洗涤晶体。
(5)用电子天平准确称取0.2440g苯甲酸样品于锥形瓶中,加100mL蒸馏水溶解(必要时可以加热),再用0.1000 mol·L-1的标准NaOH溶液滴定,共消耗NaOH溶液19.20mL,滴定选用的指示剂为___,苯甲酸样品的纯度为____%(保留4位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某兴趣小组同学设计的原电池装置,下列叙述正确的是( )
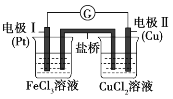
A.电极I上发生氧化反应
B.可将CuCl2溶液改为KCl溶液
C.该原电池的总反应为Fe3++Cu=Cu2++Fe2+
D.盐桥中装有含氯化钾的琼脂,K+移向CuCl2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据氧化还原反应:2Ag++Cu=Cu2++2Ag设计的原电池如图所示。请回答下列问题:

(1)电极X的材料是________;
(2)X电极发生的电极反应式为____________________;银电极上发生的电极反应为________(填“氧化”或“还原”)反应。
(3)外电路中的电子________(填“流出”或“流向”)Ag电极。
(4)当有3.2 g铜溶解时,银电极增重________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将3molSO2和1molO2充入一定容密闭容器中,在催化剂存在下进行下列反应:2SO2(g)+O2(g)![]() 2SO3(g);△H=-197kJ/mol,当达到平衡状态时,下列说法中正确的是( )
2SO3(g);△H=-197kJ/mol,当达到平衡状态时,下列说法中正确的是( )
A.达到反应限度时,生成SO3为2mol
B.达到反应限度时,反应放出的热量一定小于197kJ
C.达到反应限度时SO2、O2、SO3的分子数之比一定为2∶1∶2
D.达到反应限度时SO2的消耗速率必定等于SO3的消耗速率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com