
【题目】阅读短文,回答问题。
合成氨工业结束了人类依靠天然氮肥的历史,解决了人类的粮食问题。近一百年来,工业上一直采用在高温、高压、催化剂的条件下将氮气和氢气转化为氨气,这样的条件每年需要消耗全世界1%~2%的能源供应,科学家一直致力于探索在温和条件下合成氨。中科大研究团队研制了“钌单原子催化剂”合成氨,应用该催化剂通过电化学反应在室温下即可合成氨。原理如图1所示。
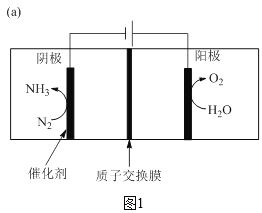
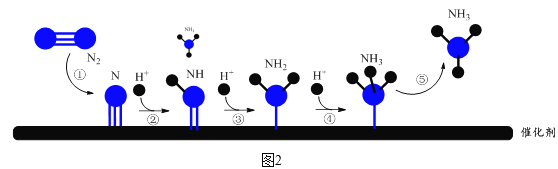
阴极表面电极反应的微观过程如图2所示。
该项研究工作开辟了单原子催化剂在电化学合成氨反应中的新途径,使得温和条件下合成氨成为可能。
请依据以上短文,判断下列说法是否正确(填“对”或“错”)。
(1)合成氨工业对解决人类的粮食问题发挥了重要作用。___
(2)传统方法合成氨的化学方程式为N2+3H2![]() 2NH3。___
2NH3。___
(3)传统合成氨的方法需消耗大量能源。___
(4)“钌单原子催化剂”合成氨体现了我国科学家在科研领域的创新。___
(5)图1中,水在阳极失去电子生成氧气。___
(6)图2中,步骤②所示反应的方程式为有N+H+NH。___
【答案】对 对 对 对 对 错
【解析】
由合成氨气的原理图可知,阴极氮气得电子,发生还原反应,生成氨气,其电极反应式为:N2+6e-+6H+=2NH3,阳极水失电子,发生氧化反应,生成氧气,其电极反应式为:2H2O-4e-=O2↑+4H+。
(1)合成氨工业的巨大成功,改变了世界粮食生产的历史,解决了人类因人口增长所需要的粮食,奠定了多相催化科学和化学工程科学基础,(1)对;
(2)传统方法合成氨是氮气和氢气在高温高压、催化剂条件下生成氨气,其化学方程式为N2+3H2![]() 2NH3,(2)对;
2NH3,(2)对;
(3)传统合成氨是在高温高压、催化剂条件下进行,苛刻的条件,对设备要求更高,需消耗大量能源,(3)对;
(4)“钌单原子催化剂”合成氨是一种温和条件下合成氨的方法,不像传统合成氨,对设备要求高、能耗大,所以“钌单原子催化剂”合成氨体现了我国科学家在科研领域的创新,(4)对;
(5)根据合成氨气的原理图可知,阳极水失电子,发生氧化反应,生成氧气,其电极反应式为:2H2O-4e-=O2↑+4H+,(5)对;
(6)步骤②所示反应为:N+H+![]() NH,(6)错误;
NH,(6)错误;


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数的值,下列有关叙述中正确的是( )
A.在NA个P4分子中含有4NA个共价键
B.在含NA个硅原子的二氧化硅晶体中含有4NA个Si—O键
C.1mol Na2O2中,含有的阴离子数为2NA
D.向FeI2溶液中通入适量Cl2,当有1mol Fe2+被氧化时,转移的电子总数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在![]() 的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )
的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )
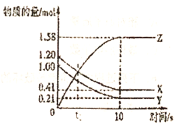
A.![]() 后,该反应停止进行
后,该反应停止进行
B.反应的化学方程式为:![]()
C.在t1时刻,正反应速率等于逆反应速率
D.反应前![]() 内,以Z表示的平均反应速率为
内,以Z表示的平均反应速率为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D都是周期表中的短周期元素,它们的核电荷数依次增大。A原子、C原子的L能层中都有两个未成对的电子,C、D同主族。E、F都是第四周期元素,E原子核外有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满。根据以上信息填空:
(1)基态D原子中,电子占据的最高能层符号为____,D基态原子含有_____个未成对电子。
(2)E2+的价层电子排布图是_______,F原子的电子排布式是_____。
(3)A的最高价氧化物对应的水化物分子结构式为____,其中心原子采取的轨道杂化方式为____,B的气态氢化物的VSEPR模型为_____。
(4)化合物AC2、B2C和阴离子DAB-互为等电子体,它们结构相似,DAB-的结构式为____。
(5)配合物甲的焰色反应呈紫色,其内界由中心离子E3+与配位体AB-构成,配位数为6。甲的水溶液可以用于实验室中E2+的定性检验,检验E2+的离子方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.4.6gC2H5OH与6.0gCH3COOH反应,生成的CH3COOC2H3分子数目为0.1NA
B.22gCO2与标准状况下11.2LHF含有相同分子数
C.25℃时,1LpH=12的Ba(OH)2溶液中含有的OH-数目为0.02NA
D.32gO2和O3的混合物中含有的氧原子数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组对SO2的性质进行探究。用如图所示装置进行实验。

(1)A的装置中浓硫酸的作用是___。
(2)请将A方框中的装置补充完整___。
(3)实验过程中,说明SO2与水反应生成了酸的实验现象是__。
(4)D的装置中发生反应的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员研制出一种室温“可呼吸”Na—CO2电池。放电时该电池“吸入”CO2,充电时“呼出”CO2。吸入CO2时,其工作原理如图所示。吸收的全部CO2中,有2/3转化为Na2CO3固体沉积在多壁碳纳米管(MWCNT)电极表面。下列说法正确的是

A.“吸入”CO2时,钠箔为负极
B.“吸入”CO2时的正极反应:4Na++3CO2-4e-=2Na2CO3+C
C.“呼出”CO2时,Na+向多壁碳纳米管电极移动
D.每“呼出”22.4LCO2,转移电子数为0.75mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某中性有机物A的分子量为88,碳的质量分数为54.5%,氢的质量分数为9.1%,其余为氧。可发生如图所示变化:
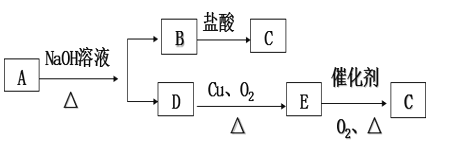
(1)C中官能团的名称是__________ 。
(2)D→E的反应类型是____________。
(3)有机物A与氢氧化钠溶液反应的化学方程式为___________。
(4)已知某烃X的相对分子质量比A小16,分子中碳与氢的质量之比为5:1。下列说法正确的是________。
A.相同条件下X的密度比水小
B. 烃X能与氢气发生还原反应
C.甲烷与烃X互为同系物
D.C、D、E可用新制氢氧化铜检验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气作为清洁能源有着广泛的应用前景,含硫天然气制备氢气的流程如图。

请回答下列问题:
Ⅰ.转化脱硫:将天然气压入吸收塔,30℃时,在T·F菌作用下,酸性环境中脱硫过程示意图如图。
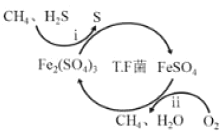
过程i的离子反应方程式为_____。
已知:①Fe3+在pH=1.9时开始沉淀,pH=3.2时沉淀完全。
②30℃时,在T·F菌作用下,不同pH的FeSO4溶液中Fe2+的氧化速率如表。
pH | 0.7 | 1.1 | 1.5 | 1.9 | 2.3 | 2.7 |
Fe2+的氧化速率 | 4.5 | 5.3 | 6.2 | 6.8 | 7.0 | 6.6 |
在转化脱硫中,请在表中选择最佳pH范围是____<pH<____,这样选择的原因是:______。
Ⅱ.蒸气转化:在催化剂的作用下,水蒸气将CH4氧化。结合如图回答问题。
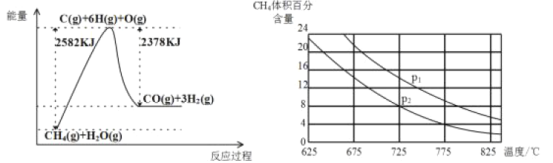
(3)①该过程的热化学方程式是_____。
②比较压强P1和P2的大小关系:P1____P2(选填“<”、“>”或“=”)。
Ⅲ.CO变换:500℃时,CO进一步与水反应生成CO2和H2。
Ⅳ.提纯:将CO2和H2分离得到H2的过程如示意图如图。
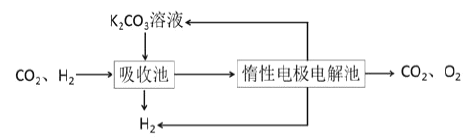
(4)吸收池中发生反应的离子方程式是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com