
【题目】实验小组对SO2的性质进行探究。用如图所示装置进行实验。

(1)A的装置中浓硫酸的作用是___。
(2)请将A方框中的装置补充完整___。
(3)实验过程中,说明SO2与水反应生成了酸的实验现象是__。
(4)D的装置中发生反应的化学方程式为___。
【答案】吸收水蒸气(干燥SO2)  B中试纸不变色,C中试纸变红色 SO2+2NaOH=Na2SO3+H2O(SO2+NaOH=NaHSO3)
B中试纸不变色,C中试纸变红色 SO2+2NaOH=Na2SO3+H2O(SO2+NaOH=NaHSO3)
【解析】
根据实验装置图分析,装置A中的浓硫酸具有干燥的作用,SO2不能使干燥的蓝色石蕊试纸变色,但因为SO2与水反应生成亚硫酸,酸能使湿润的蓝色石蕊试纸变红,最后用氢氧化钠溶液进行尾气处理。
(1)SO2与浓硫酸不反应,浓硫酸有吸水性,可以吸收SO2中的水蒸气,所以浓硫酸的作用是吸收水蒸气(干燥SO2),故答案为:吸收水蒸气(干燥SO2);
(2)A的装置中浓硫酸的作用是干燥SO2,所以气流应长进短出,装置为: ,故答案为:
,故答案为: ;
;
(3)装置B内干燥的蓝色石蕊试纸虽然与二氧化硫气体接触,但却不变色,可以说明二氧化硫气体不能使干燥的蓝色石蕊试纸变色;C装置内SO2与水反应生成亚硫酸,酸能使湿润的蓝色石蕊试纸变红,所以实验过程中,说明SO2与水反应生成了酸的实验现象是B中试纸不变色,C中试纸变红色,故答案为:B中试纸不变色,C中试纸变红色;
(4)D装置是尾气处理装置,用氢氧化钠溶液吸收SO2,化学反应方程式为:SO2+2NaOH=Na2SO3+H2O(SO2+NaOH=NaHSO3),故答案为:SO2+2NaOH=Na2SO3+H2O(SO2+NaOH=NaHSO3)。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】如图所示阴阳膜组合电解装置用于循环脱硫,用NaOH溶液在反应池中吸收尾气中的二氧化硫,将得到的Na2SO3溶液进行电解又制得NaOH。其中a、b离子交换膜将电解槽分为三个区域,电极材料为石墨,产品C为H2SO4溶液。下列说法正确的是( )

A. b为只允许阳离子通过的离子交换膜
B. 阴极区中B最初充入稀NaOH溶液,产品E为氧气
C. 反应池采用气、液逆流方式,目的是使反应更充分
D. 阳极的电极反应式为SO32-+2e-+H2O===2H++SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普伐他汀是一种调节血脂的药物,其结构简式如图所示(未表示出其空间构型)。
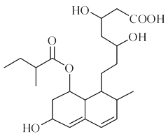
下列关于普伐他汀的性质描述正确的是 ( )
A. 能与FeCl3溶液发生显色反应
B. 该物质的分子式为C23H38O7
C. 能发生加成、取代、消去反应,能使酸性KMnO4溶液褪色
D. 1mol该物质最多可与1molNaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请从1—A和1—B两题中任选1个作答,若两题均作答,按1—A评分。___
1—A补齐物质及其用途的连线 | 1—B补齐物质及其用途的连线 |
物质用途
| 物质用途
|
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阅读短文,回答问题。
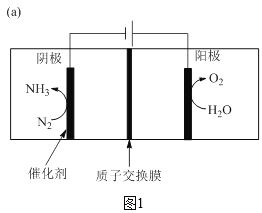
合成氨工业结束了人类依靠天然氮肥的历史,解决了人类的粮食问题。近一百年来,工业上一直采用在高温、高压、催化剂的条件下将氮气和氢气转化为氨气,这样的条件每年需要消耗全世界1%~2%的能源供应,科学家一直致力于探索在温和条件下合成氨。中科大研究团队研制了“钌单原子催化剂”合成氨,应用该催化剂通过电化学反应在室温下即可合成氨。原理如图1所示。
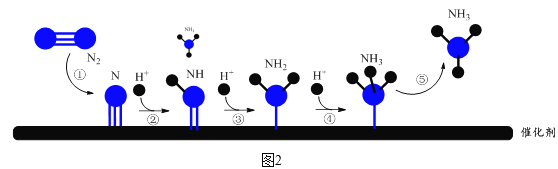
阴极表面电极反应的微观过程如图2所示。
该项研究工作开辟了单原子催化剂在电化学合成氨反应中的新途径,使得温和条件下合成氨成为可能。
请依据以上短文,判断下列说法是否正确(填“对”或“错”)。
(1)合成氨工业对解决人类的粮食问题发挥了重要作用。___
(2)传统方法合成氨的化学方程式为N2+3H2![]() 2NH3。___
2NH3。___
(3)传统合成氨的方法需消耗大量能源。___
(4)“钌单原子催化剂”合成氨体现了我国科学家在科研领域的创新。___
(5)图1中,水在阳极失去电子生成氧气。___
(6)图2中,步骤②所示反应的方程式为有N+H+NH。___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分,按要求回答问题:
① |
| ||||||||||||||||
|
|
| ② | ③ | ④ |
|
| ||||||||||
⑤ | ⑥ |
|
|
|
|
|
|
|
|
|
| ⑦ |
|
| ⑧ | ⑨ |
|
(1)请写出下列元素的元素符号:①________③_________⑨___________。
(2)元素①④按2:1组成的化合物中化学键为_________。(填“共价键”或“离子键”)
(3)②的单质与⑧的最高价氧化物水化物热的浓溶液反应的化学方程式为____________。
(4)⑤⑥⑦的最高价氧化物水化物的碱性从大到小的顺序____________。(填化学式)
(5)④⑤⑥⑧形成的简单离子,其离子半径由小到大的顺序为____________(填离子符号)。
(6)④和⑧的氢化物稳定性从大到小的顺序为______________________。(填化学式)
(7)元素④的氢化物与⑤发生反应的方程式_____________,所得溶液PH____7(填“>”或“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲醛(微溶于水、易溶于有机溶剂,密度约等于水的密度)在碱性条件下发生歧化反应可以制备苯甲醇(在水中溶解度不大、易溶于有机溶剂,密度约等于水的密度)和苯甲酸。反应原理如下:2C6H5CHO+NaOH→C6H5CH2OH+C6H5COONa、C6H5COONa+HC1→C6H5COOH+NaC1
有关物质物理性质如表:
苯甲醛 | 苯甲醇 | 苯甲酸 | 苯 | |
沸点/℃ | 178 | 205 | 249 | 80 |
熔点/℃ | 26 | -15 | 12 | 5.5 |
苯甲酸在水中的溶解度 | ||
17℃ | 25℃ | 100℃ |
0.21g | 0.34g | 5.9g |
实验流程如图:

(1)第①步需连续加热1小时(如图1),其中加热和固定装置未画出。仪器A的名称为____,若将仪器B改为仪器C,效果不如B,说明原因____。

(2)操作②的实验名称为____。
(3)操作③用沸水浴加热蒸馏,再进行操作④(如图2),收集___℃的馏分。图2中有一处明显错误,正确的应改为____。
(4)抽滤时(如图3)烧杯中苯甲酸晶体转入布氏漏斗时,杯壁上还粘有少量晶体,用___冲洗杯壁上残留的晶体,抽滤完成后用____洗涤晶体。
(5)用电子天平准确称取0.2440g苯甲酸样品于锥形瓶中,加100mL蒸馏水溶解(必要时可以加热),再用0.1000 mol·L-1的标准NaOH溶液滴定,共消耗NaOH溶液19.20mL,滴定选用的指示剂为___,苯甲酸样品的纯度为____%(保留4位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,实验现象及结论都正确且两者具有因果关系的是
实验 | 现象 | 结论 | |
A | 向Ba(NO3)2溶液中通入二氧化硫气体 | 有白色沉淀生成 | SO2与Ba(NO3)2反应得到BaSO3 |
B | 向FeI2的溶液中滴加少量的氯水 | 溶液颜色变深 | Cl2与Fe2+反应生成Fe3+ |
C | 向蔗糖溶液中加几滴稀硫酸,水浴加热5min后,再加新制Cu(OH)2后加热 | 无砖红色沉淀生成 | 蔗糖没有水解 |
D | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体 | 溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为![]() 。下列说法正确的是
。下列说法正确的是
A. 1L0.1mol·![]() NH4Cl溶液中,
NH4Cl溶液中, ![]() 的数量为0.1
的数量为0.1![]()
B. 2.4gMg与H2SO4完全反应,转移的电子数为0.1![]()
C. 标准状况下,2.24LN2和O2的混合气体中分子数为0.2![]()
D. 0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com