
【题目】如图所示阴阳膜组合电解装置用于循环脱硫,用NaOH溶液在反应池中吸收尾气中的二氧化硫,将得到的Na2SO3溶液进行电解又制得NaOH。其中a、b离子交换膜将电解槽分为三个区域,电极材料为石墨,产品C为H2SO4溶液。下列说法正确的是( )

A. b为只允许阳离子通过的离子交换膜
B. 阴极区中B最初充入稀NaOH溶液,产品E为氧气
C. 反应池采用气、液逆流方式,目的是使反应更充分
D. 阳极的电极反应式为SO32-+2e-+H2O===2H++SO42-
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:
【题目】可用于分离或提纯物质的方法有:①过滤 ②蒸馏 ③加热 ④分液(在下列空白中填写分离提纯的合理方法的序号及装置下合理的选项)。

(1)除去石灰水中悬浮的CaCO3颗粒:________。
(2)提纯氯化钠溶液中的氯化钠:___。
(3)分离汽油和煤油的混合物:______。
(4)分离水和苯的混合物:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若某氖原子质量是a g,12C的原子质量是b g,NA是阿伏加德罗常数的值,下列说法正确的是
A.氖元素的相对原子质量一定是![]()
B.该氖原子的摩尔质量是aNAg
C.Wg该氖原子的物质的量一定是![]() mol
mol
D.Wg该氖原子所含质子数是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸普鲁卡因 (  ) 是一种良好的局部麻醉药, 具有毒性小, 无成瘾性等特点。其合成路线如下图所示:
) 是一种良好的局部麻醉药, 具有毒性小, 无成瘾性等特点。其合成路线如下图所示:

回答下列问题:
(1) 3molA可以合成1molB, 且B是平面正六边形结构, 则B的结构简式为_________。
(2) 有机物C的名称为____________, B→C的反应类型为_____________。
(3) 反应C→D的化学方程式为________________________________________。
(4) F和E发生酯化反应生成G, 则F的结构简式为___________________。
(5) H的分子式为____。
(6) 分子式为C9H12且是C的同系物的同分异构体共有__________种。
(7) 请结合上述流程信息, 设计由苯、 乙炔为原料合成 的路线_______________ 。(其他无机试剂任选)
的路线_______________ 。(其他无机试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化锂(Li3N)是一种优良的贮氢材料,遇水强烈水解,在空气中加热能剧烈燃烧,下图装置中ABCD用于制取干燥、纯净的N2,装置E用于制取Li3N。
已知:锂的密度为0.534g/cm3,熔点180C,沸点1340C;锂与氨反应生成LiNH2和H2,约500C左右Li与N2反应生成Li3N。

回答下列问题:
(1)连接好装置开始实验前必须进行的操作是___。
(2)实验完成后,A、C、E装置中酒精灯撤去的顺序依次是___,装置F的仪器名称是___。
(3)装置D(未画出)所装药品是___,作用是干燥N2和___。
(4)装置E中石棉绒(透气且性质稳定)包裹的Li的作用是___,后一个Li粒装在铁舟中而不是直接放在反应管中的原因是___。
(5)装置C中反应的化学方程式为___。
(6)已知铁舟中金属锂质量为7.0g,将E中铁舟连同所装固体在实验前后进行称重,所得数据如下表所示,则Li3N的产率约为________%。(保留一位小数)
采集时间 | 实验前 | 实验后 |
实验数据 | 40.2g | 44.6g |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种免疫调节剂,其结构简式如图所示,关于该物质的说法不正确的是
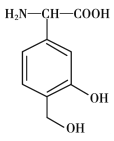
A. 属于芳香族化合物,分子式为C9H11O4N
B. 可以发生的反应类型有:加成反应、取代反应、氧化反应、聚合反应
C. 分子中所有碳原子有可能在同一平面上
D. 1mol该调节剂最多可以与3 mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25mL0.1mol·L-1某一元碱中,逐滴加入0.1mol·L-1醋酸,滴定曲线如图所示。则下列说法不正确的是

A. 该碱溶液可以溶解Al(OH)3
B. a点对应的体积值大于25mL
C. C点时,c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D. D点时,c(CH3COO-)+c(OH-)=c(H+)+c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学利用下图所示装置探究氨气的性质。

请回答:
(1)实验室用氯化铵和氢氧化钙共热制取氨气,该反应的化学方程式是____________________。
(2)①中湿润的红色石蕊试纸变蓝,说明氨气的水溶液显______(填字母)。
a.碱性 b.还原性
(3)向②中滴入浓盐酸,现象是_________________________________。
(4)①、②中的现象说明氨气能与______(填化学式)发生化学反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②酸性条件下,ClO3-不会氧化Co2+,ClO3-转化为Cl-;
③部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)

④CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶生成无水氯化钴。
请回答:
(1)写出浸出过程中Co2O3发生反应的离子方程式___________。
(2)向浸出液中加入 NaClO3发生主要反应的离子方程式___________。
(3)“加Na2CO3调pH至5.2”,过滤所得到的沉淀Ⅹ成分为___________。
(4)萃取剂对金属离子的萃取率与pH的关系如图所示,萃取剂使用的适宜pH范围是___________。(填选项序号字母)

A 1.0~2.0 B 2.5~3.5 C 4.0~5.0
(5)制得的CoCl2·6H2O在烘干时需减压烘干的原因是___________。
(6)为测定粗产品中CoCl2·6H2O含量,称取2g的粗产品溶于水,配成100mL溶液,取出20mL置于锥形瓶,加入K2CrO4做指示剂( Ag2CrO4为砖红色沉淀),用0.2mol/L的AgNO3溶液滴定至终点,重复2-3次,平均消耗AgNO3标准溶液10.00mL。该粗产品中CoCl2·6H2O的质量分数为___________。用K2CrO4做指示剂时,需要控制溶液pH值为6.5~10.5,试分析原因______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com