
【题目】若某氖原子质量是a g,12C的原子质量是b g,NA是阿伏加德罗常数的值,下列说法正确的是
A.氖元素的相对原子质量一定是![]()
B.该氖原子的摩尔质量是aNAg
C.Wg该氖原子的物质的量一定是![]() mol
mol
D.Wg该氖原子所含质子数是![]()
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】参照反应Br+H2 ![]() HBr+H的反应历程示意图,下列叙述中正确的是
HBr+H的反应历程示意图,下列叙述中正确的是

A. 该反应的反应热△H=E2﹣E1
B. 正反应为吸热反应
C. 吸热反应一定要加热后才能发生
D. 升高温度可增大正反应速率,降低逆反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2和CO可作为工业合成甲醇(CH3OH)的直接碳源,还可利用CO2据电化学原理制备塑料,既减少工业生产对乙烯的依赖,又达到减少CO2排放的目的。
(1)利用CO2和H2反应合成甲醇的原理为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。
上述反应常用CuO和ZnO的混合物作催化剂。相同的温度和时间段内,催化剂中CuO的质量分数对CO2的转化率和CH3OH的产率影响的实验数据如下表所示:
ω(CuO)/% | 10 | 20 | 30 | 4b | 50 | 60 | 70 | 80 | 90 |
CH3OH的产率 | 25% | 30% | 35% | 45% | 50% | 65% | 55% | 53% | 50% |
CO2的转化率 | 10% | 13% | 15% | 20% | 35% | 45% | 40% | 35% | 30% |
由表可知,CuO的质量分数为________催化效果最佳。
(2)利用CO和H2在一定条件下可合成甲醇,发生如下反应:CO(g)+2H2(g)![]() CH3OH(g),其两种反应过程中能量的变化曲线如下图a、b所示,下列说法正确的是(______)
CH3OH(g),其两种反应过程中能量的变化曲线如下图a、b所示,下列说法正确的是(______)

A.上述反应的ΔH=-91kJ·mol-1
B.a反应正反应的活化能为510kJ·mol-1
C.b过程中第Ⅰ阶段为吸热反应,第Ⅱ阶段为放热反应
D.b过程使用催化剂后降低了反应的活化能和ΔH
E.b过程的反应速率:第Ⅱ阶段>第Ⅰ阶段
(3)①在1L的恒定密闭容器中按物质的量之比1︰2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化情况如图1所示,则压强P2________P1(填“>”、“<”或“=”);平衡由A点移至C点、D点移至B点,分别可采取的具体措施为________、________;在c点时,CO的转化率为________。
②甲和乙两个恒容密闭容器的体积相同,向甲中加入1molCO和2molH2,向乙中加入2molCO和4molH2,测得不同温度下CO的平衡转化率如图2所示,则L、M两点容器内压强:P(M)________2P(L);平衡常数:K(M)________K(L)。(填“>”、“<”或“=”)

(4)以纳米二氧化钛膜为工作电极,稀硫酸为电解质溶液,在一定条件下通入CO2进行电解,在阴极可制得低密度聚乙烯![]() (简称LDPE)。
(简称LDPE)。
①电解时,阴极的电极反应式是________。
②工业上生产1.4×102kg的LDPE,理论上需要标准状况下________L的CO2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将NaOH溶液分别加到HA、HB两种弱酸溶液中,两溶液中pH与粒子浓度比值的对数关系如图所示,已知pK=-lgKa。下列有关叙述错误的是
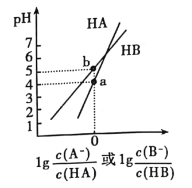
A. HA、HB两种酸中,HB的酸性弱于HA
B. b点时,c(B—)=c(HB)>c(Na+)>c(H+)>c(OH—)
C. 同浓度同体积的NaA和NaB溶液中,阴离子总数相等
D. 向HB溶液中加入NaOH溶液所得的混合溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷化镓(GaAs)是优良的半导体材料,可用于制作微型激光器或太阳能电池的材料等。

试回答下列问题
(1)写出基态As原子的核外电子排布式_______。
(2)根据元素周期律,原子半径Ga _____As(填“>”或“<”下同),第一电离能Ga _____As
(3)AsCl5分子的立体构型为___________,其中As的杂化轨道类型为_______。
(4)GaF3的熔点高于1000℃,GaCl3的熔点为79℃,其原因是________。
(5)GaAs的熔点为1238℃,其晶胞结构如图所示。该晶体的类型为_______,与As以_____键键合。已知阿伏加德罗常数为NA,晶胞参数![]() =lnm,此晶体的密度为_____ g·cm—3(写出计算式)。
=lnm,此晶体的密度为_____ g·cm—3(写出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 实验室采用如图所示装置制备乙酸乙酯,实验结束后,取下盛有饱和碳酸钠溶液的试管,再沿该试管内壁缓缓加入紫色石蕊试液1毫升,发现紫色石蕊试液存在于饱和碳酸钠溶液层与乙酸乙酯液层之间(整个过程不振荡试管),下列有关该实验的描述,不正确的是( )

A.制备的乙酸乙酯中混有乙酸和乙醇杂质
B.该实验中浓硫酸的作用是催化和吸水
C.饱和碳酸钠溶液主要作用是降低乙酸乙酯的溶解度及吸收乙醇、中和乙酸
D.石蕊层为三层环,由上而下是蓝、紫、红
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)如图是几种烷烃的球棍模型:

(1)A、B、E三种烷烃的关系为___________,C、D、E的关系为__________。
(2)D的名称是__________(习惯命名法)。
(3)E的一氯代物有_______种,请写出一氯代物的结构简式:________________。
(II)甲烷、乙烯、苯三种有机物中具有下列性质的是
(1)在催化剂作用下能与纯溴反应,不能使酸性高锰酸钾溶液褪色的是________。
(2)见光能跟氯气发生取代反应,不能使酸性高锰酸钾溶液褪色的是________。
(3)在催化剂作用下加氢生成乙烷,加水生成酒精的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示阴阳膜组合电解装置用于循环脱硫,用NaOH溶液在反应池中吸收尾气中的二氧化硫,将得到的Na2SO3溶液进行电解又制得NaOH。其中a、b离子交换膜将电解槽分为三个区域,电极材料为石墨,产品C为H2SO4溶液。下列说法正确的是( )

A. b为只允许阳离子通过的离子交换膜
B. 阴极区中B最初充入稀NaOH溶液,产品E为氧气
C. 反应池采用气、液逆流方式,目的是使反应更充分
D. 阳极的电极反应式为SO32-+2e-+H2O===2H++SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2的排放会带来全球“温室”效应,因此,引起国际关注和研究,渴望21世纪 CO2将作为新碳源被广泛使用。
(1)以 CO2 和 H2 为原料可得到 CH4 燃料。
已知:① CH4 (g) + CO2(g) = 2CO(g) + 2H2(g) △ H1= + 247kJ·mol-1
② CH4 (g) + H2O(g) = CO(g) + 3H2(g) △ H2= + 205kJ·mol-1
写出由 CO2 获得CH4的热化学方程式:_____。
(2)CO2与CH4经催化重整可制得合成气:CH4(g)+CO2(g) = CO(g)+2H2(g) 按一定体积比加入CH4和CO2,在恒压下发生反应,温度对CO和H2产率影响如图所示。此反应优选温度为900℃的原因是______________________。


(3)以二氧化钛表面覆盖的Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。
① 催化剂的催化效率与乙酸的生成速率随温度的变化关系如上图所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是__________________。
② 为了提高该反应中CH4的转化率,可以采取的措施是________(写出两种) 。
③ 将Cu2Al2O4溶解在稀硝酸中离子方程式是________________________。

(4)O2辅助的Al—CO2电池工作原理如上图所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。电池的负极反应式:_______________________。电池的正极反应式:2CO2+2e= C2O42该过程中,O2起催化作用,催化过程可表示为:i: 6 O2 + 6e = 6 O2 ii: ……写出ii的离子方程式:______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com