
【题目】如图是元素周期表的一部分,按要求回答问题:
① |
| ||||||||||||||||
|
|
| ② | ③ | ④ |
|
| ||||||||||
⑤ | ⑥ |
|
|
|
|
|
|
|
|
|
| ⑦ |
|
| ⑧ | ⑨ |
|
(1)请写出下列元素的元素符号:①________③_________⑨___________。
(2)元素①④按2:1组成的化合物中化学键为_________。(填“共价键”或“离子键”)
(3)②的单质与⑧的最高价氧化物水化物热的浓溶液反应的化学方程式为____________。
(4)⑤⑥⑦的最高价氧化物水化物的碱性从大到小的顺序____________。(填化学式)
(5)④⑤⑥⑧形成的简单离子,其离子半径由小到大的顺序为____________(填离子符号)。
(6)④和⑧的氢化物稳定性从大到小的顺序为______________________。(填化学式)
(7)元素④的氢化物与⑤发生反应的方程式_____________,所得溶液PH____7(填“>”或“<”或“=”)。
【答案】H N Cl 共价键 C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O NaOH>Mg(OH)2>Al(OH)3 Mg2+<Na+<O2-<S2- H2O>H2S 2Na+2H2O=2NaOH+H2↑ >
CO2↑+2SO2↑+2H2O NaOH>Mg(OH)2>Al(OH)3 Mg2+<Na+<O2-<S2- H2O>H2S 2Na+2H2O=2NaOH+H2↑ >
【解析】
根据各元素在周期表中的位置,各元素为:①H②C③N④O⑤Na⑥Mg⑦Al⑧S⑨Cl。
(1)根据各元素在周期表中的位置,元素的元素符号:①H③N⑨Cl。故答案为:H;N;Cl;
(2)元素①④按2:1组成的化合物为H2O,H与O之间通过共用电子对形成的化学键为共价键。故答案为:共价键;
(3)碳和浓硫酸反应生成二氧化碳、二氧化硫和水,反应的化学方程式C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O,故答案为:C+2H2SO4(浓)
CO2↑+2SO2↑+2H2O,故答案为:C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O;
CO2↑+2SO2↑+2H2O;
(4)同周期从左到右元素的金属性减弱,最高价氧化物水化物的碱性减弱,金属性:Na>Mg>Al,最高价氧化物水化物的碱性从大到小的顺序NaOH>Mg(OH)2>Al(OH)3。故答案为:NaOH>Mg(OH)2>Al(OH)3;
(5)电子层结构相同的离子,核电荷越大,半径越小,④⑤⑥形成的简单离子,Mg2+<Na+<O2-,S2-比O2-多一个电子层,S2-半径大,④⑤⑥⑧形成的简单离子,其离子半径由小到大的顺序为Mg2+<Na+<O2-<S2-。故答案为:Mg2+<Na+<O2-<S2-;
(6)④和⑧属于同一主族,从上到下氢化物稳定性减弱,氢化物稳定性从大到小的顺序为H2O>H2S。故答案为:H2O>H2S;
(7)水与钠发生反应生成氢氧化钠和氢气,方程式2Na+2H2O=2NaOH+H2↑,所得NaOH溶液呈强碱性,pH>7。故答案为:2Na+2H2O=2NaOH+H2↑,>。


科目:高中化学 来源: 题型:
【题目】Fe(OH)2在空气中容易变质。某同学欲利用如图所示装置制取能较长时间存在的Fe(OH)2,其中实验所用溶液现配现用且蒸馏水先加热煮沸。请回答下列问题:
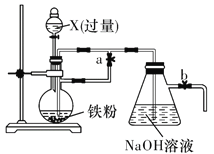
(1)X可以是________(填字母代号)。
A.稀硫酸 B.浓硫酸
C.稀硝酸 D.稀盐酸
(2)实验开始时,向烧瓶中加入X前,应________(填字母代号)。
A.先关闭止水夹a、b B.先打开止水夹a、b
C.先关闭止水夹b、打开a D.先关闭止水夹a、打开b.
(3)烧瓶中发生反应的离子方程式为___________________________________________。
(4)反应一会后,在b导管口收集检验氢气纯净后,关闭______(填“a”或“b”),一段时间后,可在烧瓶中观察到的现象是_________________________________________________________。
(5)反应结束后,为确保Fe(OH)2可较长时间存在,则应关闭分液漏斗活塞和止水夹________(填“a”或“b”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①—⑨在表中的位置,回答问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
1 | ① | |||||||
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)表中⑧元素单质可用作________。
(2)③、④、⑧的原子半径最小是________(用元素符号回答)。
(3)⑤、⑥、⑦的最高价氧化物对应的水化物中,碱性最强的是________(用化学式回答)。
(4)②、③、④的气态氢化物中,稳定性最弱的是________(用化学式回答)(5)②和③按原子数![]() 形成的化合物的电子式为________,该晶体气化的过程中克服的微粒间作用力为________。
形成的化合物的电子式为________,该晶体气化的过程中克服的微粒间作用力为________。
(6)③和⑧形成的化合物属于________(填“离子化合物”或“共价化合物”),该晶体属于________晶体(填“离子”、“分子”、“原子”)。
(7)元素⑤、⑦的最高价氧化物的水化物互相反应的化学方程式为:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学电源的发明是化学对人类的一项重大贡献。
(1)将锌片、铜片按照如图所示装置连接,铜片做__极(填“正”或“负”),外电路电子的流向为__(填“Cu→Zn”或“Zn→Cu”)。

(2)若将装置中的稀H2SO4用CuSO4溶液替代,则相应原电池的总反应的化学方程式为__。
(3)下列化学反应通过原电池装置,可实现化学能直接转化为电能的是__(填序号)。
①NaOH+HCl=NaCl+H2O
②CH4+2O2![]() CO2+2H2O
CO2+2H2O
③Fe+Cu2+=Cu+Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验小组对SO2的性质进行探究。用如图所示装置进行实验。

(1)A的装置中浓硫酸的作用是___。
(2)请将A方框中的装置补充完整___。
(3)实验过程中,说明SO2与水反应生成了酸的实验现象是__。
(4)D的装置中发生反应的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下为氨气部分用途

下列有关叙述错误的是
A.NH4NO3是常用化肥
B.在硝酸工业中氮元素的化合价变化情况:-3→+2→+4→+5
C.NH3和NO2在一定条件下发生氧化还原反应,其化学方程式:8NH3+6NO2![]() 7N2+12H2O
7N2+12H2O
D.NH3在氮肥工业中氮元素被还原,而在硝酸工业中氮元素被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能I1(Zn)___I1(Cu)(填“大于”或“小于”)。
(2)基态Fe2+的电子排布式为___。
(3)在N、Mg、Al、Si四种元素中,有一种元素的电离能数据如下:
电离能 | I1 | I2 | I3 | I4 | … |
I0/kJ·mol-1 | 578 | 1817 | 2745 | 11575 | … |
则该元素的元素符号是___。
(4)NO3-的空间构型__(用文字描述),SO42-中硫原子的杂化方式为___。
(5)LiAlH4是有机合成中常用的还原剂,LiAlH4中的阴离子空间构型是___、中心原子的杂化形式为___。根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是___。
(6)与O3分子互为等电子体的一种阴离子为___(填化学式)。
(7)N2分子中σ键与π键的数目比n(σ):n(π)=___。
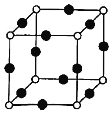
(8)Cu、N两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是___(用元素符号表示);若晶胞的棱长a nm,阿伏加德罗常数为NA,则该晶体的密度为___g/cm3(用含a、NA的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在25 ℃、101 kPa的条件下,

请回答下列有关问题:
①由H+H→H2,当生成1 mol H2时,要________(填“吸收”或“放出”,下同)436 kJ的能量;由Cl2→Cl+Cl,当断裂1 mol Cl2中的共价键时,要________243 kJ的能量。
②对于反应H2(g)+Cl2(g)=2HCl(g),测得生成2 molHCl(g)时,反应过程中放出183 kJ的热量,则断开 1 mol H—Cl 键所需的能量是________kJ。
③有两个反应:a.H2(g)+Cl2(g)![]() 2HCl(g),b.H2(g)+Cl2(g)
2HCl(g),b.H2(g)+Cl2(g)![]() 2HCl(g)。这两个反应中,相同物质的量的H2(g)、Cl2(g)反应生成相同质量的HCl(g)时,放出的能量________(填“相等”或“不相等”)。
2HCl(g)。这两个反应中,相同物质的量的H2(g)、Cl2(g)反应生成相同质量的HCl(g)时,放出的能量________(填“相等”或“不相等”)。
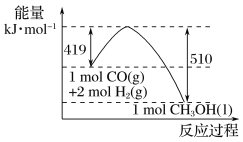
(2)根据图示的能量转化关系判断,生成16 g CH3OH(l)________(填“吸收”或“放出”)________kJ能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量CO2通入某浓度的NaOH溶液得溶液A,向A溶液中逐滴滴入稀盐酸,加入n(HCl)与生成n(CO2)的关系如图。以下有关表达正确的选项是

A.通入的CO2气体在标准状况下等于22.4L
B.溶液中n(NaOH)=2n(Na2CO3)
C.A溶液中既含Na2CO3,又含NaHCO3
D.A溶液中一定只有Na2CO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com