
【题目】一定量CO2通入某浓度的NaOH溶液得溶液A,向A溶液中逐滴滴入稀盐酸,加入n(HCl)与生成n(CO2)的关系如图。以下有关表达正确的选项是

A.通入的CO2气体在标准状况下等于22.4L
B.溶液中n(NaOH)=2n(Na2CO3)
C.A溶液中既含Na2CO3,又含NaHCO3
D.A溶液中一定只有Na2CO3
【答案】AB
【解析】
由图象可知,加入盐酸3mol时,开始生成CO2,共消耗1molHCl,发生NaHCO3+HCl=NaCl+CO2↑+H2O,如开始加入盐酸时中发生Na2CO3+HCl=NaCl+NaHCO3,则应消耗1mol盐酸,但至开始生成二氧化碳时消耗3mol盐酸,则说明溶液中含有NaOH和Na2CO3,开始时先后发生NaOH+HCl=NaCl+H2O、Na2CO3+HCl=NaCl+NaHCO3;
A.由图象可知生成二氧化碳1mol,则通入的CO2气体在标准状况下应为22.4L,故A错正确;
B.由图象可知,反应共生成1mol二氧化碳,则溶液中含有1molNa2CO3,而生成二氧化碳之前分别发生NaOH+HCl=NaCl+H2O、Na2CO3+HCl=NaCl+NaHCO3,共消耗3molHCl,由方程式可知Na2CO3消耗1molHCl,则NaOH消耗2molHCl,则NaOH为2mol,所以n(NaOH)=2n(Na2CO3),故B正确;
C.由以上分析可知A中含有Na2CO3和NaOH,故C错误;
D.A溶液应为Na2CO3和NaOH的混合物,故D错误。
故选AB。


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分,按要求回答问题:
① |
| ||||||||||||||||
|
|
| ② | ③ | ④ |
|
| ||||||||||
⑤ | ⑥ |
|
|
|
|
|
|
|
|
|
| ⑦ |
|
| ⑧ | ⑨ |
|
(1)请写出下列元素的元素符号:①________③_________⑨___________。
(2)元素①④按2:1组成的化合物中化学键为_________。(填“共价键”或“离子键”)
(3)②的单质与⑧的最高价氧化物水化物热的浓溶液反应的化学方程式为____________。
(4)⑤⑥⑦的最高价氧化物水化物的碱性从大到小的顺序____________。(填化学式)
(5)④⑤⑥⑧形成的简单离子,其离子半径由小到大的顺序为____________(填离子符号)。
(6)④和⑧的氢化物稳定性从大到小的顺序为______________________。(填化学式)
(7)元素④的氢化物与⑤发生反应的方程式_____________,所得溶液PH____7(填“>”或“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随![]() 的变化如图所示,下列叙述错误的是( )
的变化如图所示,下列叙述错误的是( )

A. MOH的碱性强于ROH的碱性
B. ROH的电离程度:b点大于a点
C. 若两溶液无限稀释,则它们的c(OH-)相等
D. 当![]() =2时,若两溶液同时升高温度,则
=2时,若两溶液同时升高温度,则![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl广泛应用于化工和印染等行业。某研究性学习小组拟热分解结晶水合物CuCl·2H2O制备CuCl,并进行相关探究。
查阅资料:CuCl22H2O ![]() CuCl2
CuCl2 ![]() CuCl+Cl2;CuCl22H2O
CuCl+Cl2;CuCl22H2O![]() Cu2(OH)2Cl2
Cu2(OH)2Cl2![]() CuO
CuO
(实验探究)该小组用下图所示装置进行实验(夹持仪器略)。
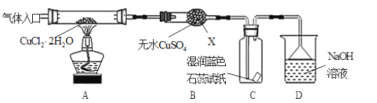
请回答下列问题:
(1)仪器X的名称是___;装置D中倒扣的三角漏斗的作用是_____;
(2)实验操作的先后顺序是a→____→____→____→e (填操作的编号)。
a.检查装置的气密性后加入药品 b.熄灭酒精灯,冷却 c.在“气体入口”处通入干燥HCl d.点燃酒精灯,加热 e.停止通入HCl,然后通入N2
(3)在实验过程中,观察到B中物质由白色变为蓝色,C中试纸的颜色变化是____;
(4)装置D中发生的氧化还原反应的离子方程式是_____;
(5)反应结束后,取出CuCl产品进行实验,发现其中含有少量的CuCl2或CuO杂质,根据资料信息
①若杂质是CuCl2,则产生的原因是____;
②若杂质是CuO,则产生的原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为![]() 。下列说法正确的是
。下列说法正确的是
A. 1L0.1mol·![]() NH4Cl溶液中,
NH4Cl溶液中, ![]() 的数量为0.1
的数量为0.1![]()
B. 2.4gMg与H2SO4完全反应,转移的电子数为0.1![]()
C. 标准状况下,2.24LN2和O2的混合气体中分子数为0.2![]()
D. 0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室有NH4HCO3和NaHSO3的干燥粉状混合物,某化学兴趣小组测定其中NH4HCO3的含量。小组的同学设计用在混合物中加酸的实验方法来测定其中NH4HCO3的质量分数。(SO2与酸性KMnO4的反应原理:SO2+MnO4-+H+—SO42-+Mn2++H2O)回答以下问题:
(1)化学小组要紧选用了以下药品和仪器进行实验(图中每种仪器装置只选用了一次,铁架台等固定仪器未画出)
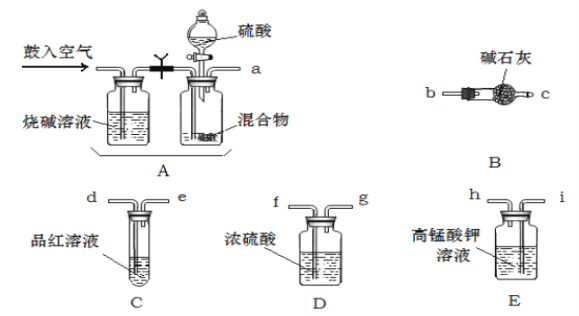
请按气流由左向右的方向,仪器连接顺序是〔填仪器的接口字母a、b...)a→_______f→g→_______。
(2)实验开始,混合物加酸前,A装置需要鼓入空气,作用是;加酸后A装置再次鼓入空气的作用是_______。
(3)E装置的作用是:_______。
(4)实验中,假设C试管中溶液褪色,那么测定结果可能会偏_______,为了确保实验中C试管中溶液不褪色,假设取样品的质量为mg,实验前E中所装amol·L-1的KMnO4溶液体积〔V〕应多于______mL;
(5)假设混合物样品质量为9.875g,充分作用后碱石灰增重4.4g,那么混合物中NH4HCO3的质量分数为_______。
(6)从定量测定的准确性的角度考虑,该套装置还应作进一步的改进,改进的措施是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,容积为2L的密闭容器中,将2molM气体和3molN气体混合,发生下列反应:2M(g) + 3N(g)![]() xQ(g) + 3R(g),该反应达到平衡时生成2.4molR,并测得Q浓度为0.4 mol·L-1,下列叙述正确的是
xQ(g) + 3R(g),该反应达到平衡时生成2.4molR,并测得Q浓度为0.4 mol·L-1,下列叙述正确的是
A. X值为2 B. 容器内压强不变
C. 平衡时N的浓度为0.6mol/L D. M的转化率为80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二硫化钨(WS,WS2中W的化合价为+4)可用作润滑剂及石油化工领域中的催化剂。由钨铁矿(其主要成分是FeWO4,还含少量Al2()3)制备二硫化钨的工艺流程如图所示,下列说法正确的是
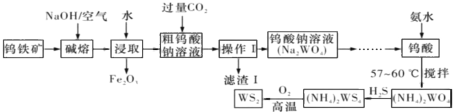
A.操作I中用到的玻璃仪器只有漏斗、烧杯
B.FeWO4在碱熔过程中发生反应的化学方程式为4FeWO4+O2+8NaOH![]() 2Fe2O3+4NaWO3+4H2O
2Fe2O3+4NaWO3+4H2O
C.生成二硫化钨的化学方程式为(NH4)2WS4+3O2![]() 2WS2+4NH3+2S2-+2SO2+2H2O,若生成124g WS2,则该反应所转移的电子数目为2NA
2WS2+4NH3+2S2-+2SO2+2H2O,若生成124g WS2,则该反应所转移的电子数目为2NA
D.滤渣I的主要成分是氢氧化铝,CO2可以用过量盐酸代替
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是
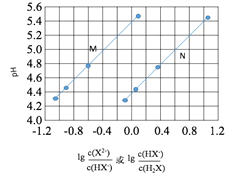
A. Ka2(H2X)的数量级为10-6
B. 曲线N表示pH与 的变化关系
的变化关系
C. NaHX溶液中c(H+)>c(OH-)
D. 当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(H+)=c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com