
【题目】设NA代表阿伏加德罗常数的值,下列有关叙述中正确的是( )
A.在NA个P4分子中含有4NA个共价键
B.在含NA个硅原子的二氧化硅晶体中含有4NA个Si—O键
C.1mol Na2O2中,含有的阴离子数为2NA
D.向FeI2溶液中通入适量Cl2,当有1mol Fe2+被氧化时,转移的电子总数为3NA
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】铁被誉为“第一金属”,铁及其化合物在生活中有广泛应用
(1)基态Fe3+的电子排布式为________。
(2)实验室用KSCN溶液、苯酚(![]() )检验Fe3+。N、O、S的第一电离能由大到小的顺序为_______(用元素符号表示),苯酚中碳原子的杂化轨道类型为______。
)检验Fe3+。N、O、S的第一电离能由大到小的顺序为_______(用元素符号表示),苯酚中碳原子的杂化轨道类型为______。
(3)FeCl3的熔点为306℃,沸点为315℃ FeCl3的晶体类型是______。FeSO4常作补铁剂,SO42-的立体构型是_______。
(4)基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等,1 mol Fe(CO)5分子中含σ键数目为_______,与CO互为等电子体的离子是__________(填化学式,写一种)
(5)氮化铁晶体的晶体结构示意图如图1所示。该晶体中铁、氮的微粒个数之比为______。
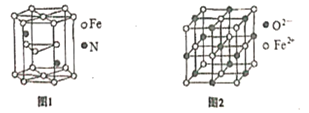
(6)氧化亚铁晶体的晶胞如图2所示。已知:氧化亚铁晶体的密度为ρg·cm-1,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为_____;Fe2+与O2-的最短间距为_______ pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如右图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是( )

A. 上下移动①中铜丝可控制SO2的量
B. ②中选用品红溶液验证SO2的生成
C. ③中选用NaOH溶液吸收多余的SO2
D. 为确认CuSO4生成,向①中加水,观察颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,满足表中图示物质在一定条件下,一步转化关系的组合有( )
序号 | X | Y | Z | W |
|
① | Si | Na2SiO3 | H2SiO3 | SiO2 | |
② | Na | NaOH | Na2CO3 | NaCl | |
③ | Cl2 | Ca(ClO)2 | HClO | HCl | |
④ | Fe | FeCl3 | FeCl2 | Fe(OH)2 |
A.①②③B.①③C.②③D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,反应:6H2 + 2CO2![]() C2H5OH + 3H2O的数据如下图所示。
C2H5OH + 3H2O的数据如下图所示。


下列说法正确的是
A.该反应的△H > 0
B.达平衡时,v(H2)正 = v(CO2)逆
C.b点对应的平衡常数K值大于c点
D.a点对应的H2的平衡转化率为90 %
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示阴阳膜组合电解装置用于循环脱硫,用NaOH溶液在反应池中吸收尾气中的二氧化硫,将得到的Na2SO3溶液进行电解又制得NaOH。其中a、b离子交换膜将电解槽分为三个区域,电极材料为石墨,产品C为H2SO4溶液。下列说法正确的是( )

A. b为只允许阳离子通过的离子交换膜
B. 阴极区中B最初充入稀NaOH溶液,产品E为氧气
C. 反应池采用气、液逆流方式,目的是使反应更充分
D. 阳极的电极反应式为SO32-+2e-+H2O===2H++SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某课外活动小组用如图装置进行实验,试回答下列问题:
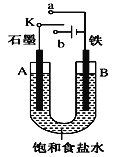
①若开始时开关K与a连接,则A极的电极反应式为____B极的Fe发生_____腐蚀(填“析氢”或“吸氧”)
②若开始时开关K与b连接,则装置内总反应的离子方程式为______;根据此时的装置,判断下列说法正确的是_____(填序号)
a. 溶液中Na+向A极移动
b. 从A极处逸出的气体能使湿润的KI淀粉试纸变蓝
c. 反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
d. 若标准状况下B极产生2.24L气体,则溶液中转移0.2mol电子
(2)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料。如LiFePO4电池中某电极的工作原理如下图所示:
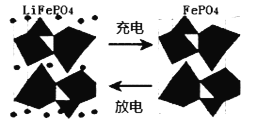
①已知该电池的电解质为能传导Li+的固体材料。放电时该电极是电池的_____极(填“正”或“负”),该电极反应式为_____。
②用此电池电解含有0.1mol/LCuSO4和0.1mol/LNaCl的混合溶液100mL,假如电路中转移了0.02mole-,且电解池的电极均为惰性电极,则阳极产生的气体在标准状况下的体积是_____L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)![]() 的名称是_______。
的名称是_______。
(2)分子式符合C7H16且含有四个甲基的结构有__________种。
(3)核磁共振仪处理![]() ,氢谱图中有___种氢,峰面积之比为____。
,氢谱图中有___种氢,峰面积之比为____。
(4)水的熔沸点比同主族其它氢化物的都高,原因是______。
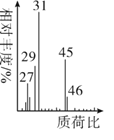
(5)将有机物A置于氧气流中充分燃烧,实验测得:生成5.4gH2O和8.8gCO2,消耗氧气6.72L(标准状况下),则A的实验式是___,用质谱仪测定A的相对分子质量,得到如图所示质谱图,则其相对分子质量为____,A的分子式是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阅读短文,回答问题。
合成氨工业结束了人类依靠天然氮肥的历史,解决了人类的粮食问题。近一百年来,工业上一直采用在高温、高压、催化剂的条件下将氮气和氢气转化为氨气,这样的条件每年需要消耗全世界1%~2%的能源供应,科学家一直致力于探索在温和条件下合成氨。中科大研究团队研制了“钌单原子催化剂”合成氨,应用该催化剂通过电化学反应在室温下即可合成氨。原理如图1所示。
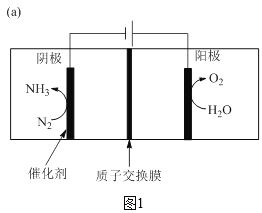
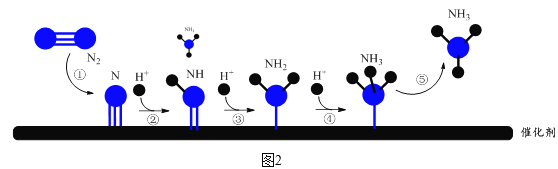
阴极表面电极反应的微观过程如图2所示。
该项研究工作开辟了单原子催化剂在电化学合成氨反应中的新途径,使得温和条件下合成氨成为可能。
请依据以上短文,判断下列说法是否正确(填“对”或“错”)。
(1)合成氨工业对解决人类的粮食问题发挥了重要作用。___
(2)传统方法合成氨的化学方程式为N2+3H2![]() 2NH3。___
2NH3。___
(3)传统合成氨的方法需消耗大量能源。___
(4)“钌单原子催化剂”合成氨体现了我国科学家在科研领域的创新。___
(5)图1中,水在阳极失去电子生成氧气。___
(6)图2中,步骤②所示反应的方程式为有N+H+NH。___
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com