
【题目】铁被誉为“第一金属”,铁及其化合物在生活中有广泛应用
(1)基态Fe3+的电子排布式为________。
(2)实验室用KSCN溶液、苯酚(![]() )检验Fe3+。N、O、S的第一电离能由大到小的顺序为_______(用元素符号表示),苯酚中碳原子的杂化轨道类型为______。
)检验Fe3+。N、O、S的第一电离能由大到小的顺序为_______(用元素符号表示),苯酚中碳原子的杂化轨道类型为______。
(3)FeCl3的熔点为306℃,沸点为315℃ FeCl3的晶体类型是______。FeSO4常作补铁剂,SO42-的立体构型是_______。
(4)基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等,1 mol Fe(CO)5分子中含σ键数目为_______,与CO互为等电子体的离子是__________(填化学式,写一种)
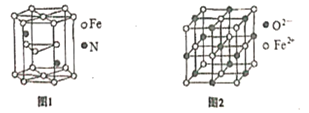
(5)氮化铁晶体的晶体结构示意图如图1所示。该晶体中铁、氮的微粒个数之比为______。
(6)氧化亚铁晶体的晶胞如图2所示。已知:氧化亚铁晶体的密度为ρg·cm-1,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为_____;Fe2+与O2-的最短间距为_______ pm。
【答案】1s22s22p63s23p63d5或[Ar] 3d5 N>O>S sp2 分子晶体 正四面体形 10NA CN- 或C22- 3∶1 12 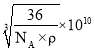
【解析】
(1)铁原子序数为26,核外电子排布式为1s22s22p63s23p63d64s2,失去4s能级上2个电子、3d能级上1个电子生成Fe3+;
(2)根据同一周期元素的第一电离能随着原子序数的增大呈增大趋势,同一主族元素的第一电离能随着原子序数的增大而减小,结合半充满和全充满较为稳定分析判断;苯酚为苯上的一个H原子被-OH取代而成,苯和苯酚均为平面结构,据此分析判断碳原子的杂化方式;
(3)分子晶体熔沸点较低且熔融不导电,据此判断晶体类型;根据SO42-中心原子含有的共价键个数与孤电子对个数之和确定其空间构型和杂化方式;
(4)Fe与CO形成5个配位键,属于σ键,CO分子中形成1个σ键;原子数目相等、价电子总数相等的微粒互为等电子体;
(5)根据均摊法分析计算计算铁、氮的微粒个数之比;
(6)依据图2可知,上、中、下三层各有4个氧离子与中心的氧离子紧邻且等距离,而氧化亚铁中氧离子、亚铁离子个数比为1∶1,所以有12个二价铁离子与二价铁离子相邻且等距离;根据均摊法计算晶胞中二价铁离子、氧离子数目,依据氧化亚铁晶体的密度计算Fe2+与O2-最短核间距。
(1)铁原子失去4s能级上2个电子、3d能级上1个电子生成Fe3+,其核外电子排布式为1s22s22p63s23p63d5,简化的电子排布式为[Ar]3d5;故答案为:1s22s22p63s23p63d5或[Ar]3d5;
(2)同一周期元素的第一电离能随着原子序数的增大呈增大趋势,同一主族元素的第一电离能随着原子序数的增大而减小即第一电离能O>S,氮元素2p能级处于半满稳定状态,能量低,氮元素的第一电离能高于同周期相邻元素第一电离能,所以第一电离能N>O>S;苯酚为苯上的一个H原子被-OH取代而成,苯和苯酚均为平面结构,C原子采取sp2杂化,故答案为:N>O>S;sp2;
(3)FeCl3的熔点为306℃,沸点为315℃,据此可知氯化铁熔沸点较低,则氯化铁属于分子晶体;SO42-离子中S原子的价层电子对数=4+![]() =4,即含有4个σ键、没有孤电子对,所以其VSEPR模型和立体构型均是正四面体,故答案为:分子晶体;正四面体形;
=4,即含有4个σ键、没有孤电子对,所以其VSEPR模型和立体构型均是正四面体,故答案为:分子晶体;正四面体形;
(4)Fe与CO形成5个配位键,属于σ键,CO分子中形成1个σ键,故Fe(CO)5分子含有10个σ键,则1molFe(CO)5分子中含10molσ键;原子数目相等、价电子总数相等的微粒互为等电子体,与CO互为等电子体的离子有CN-、C22-等,故答案为:10 NA;CN-或C22-;
(5)氮化铁晶体为六棱柱:顶点贡献率为![]() ,面点贡献率为
,面点贡献率为![]() ,依据晶胞结构可知,12个铁原子位于顶点,2个铁原子位于面心,3个铁原子位于体内,2个氮原子位于体内,1个晶胞含有铁微粒数为:12×
,依据晶胞结构可知,12个铁原子位于顶点,2个铁原子位于面心,3个铁原子位于体内,2个氮原子位于体内,1个晶胞含有铁微粒数为:12×![]() +2×
+2×![]() +3=6、含氮原子数为2,所以该晶体中铁、氮的微粒个数之比为6∶2=3∶1,故答案为:3∶1;
+3=6、含氮原子数为2,所以该晶体中铁、氮的微粒个数之比为6∶2=3∶1,故答案为:3∶1;
(6)依据图2可知,上、中、下三层各有4个氧离子与中心的氧离子紧邻且等距离,而氧化亚铁中氧离子、亚铁离子个数比为1∶1,所以有12个二价铁离子与二价铁离子相邻且等距离;1个氧化亚铁晶胞含有亚铁离子数目为:8×![]() +6×
+6×![]() =4,含有氧离子数目为:12×
=4,含有氧离子数目为:12×![]() +1=4,所以1个氧化亚铁晶胞含有4个“FeO”微粒,晶胞质量m=
+1=4,所以1个氧化亚铁晶胞含有4个“FeO”微粒,晶胞质量m=![]() g,设Fe2+与O2-最短核间距为xpm,则晶胞边长为2xpm,晶胞体积V=(2x×10-10)3cm3,氧化亚铁晶体的密度ρ=
g,设Fe2+与O2-最短核间距为xpm,则晶胞边长为2xpm,晶胞体积V=(2x×10-10)3cm3,氧化亚铁晶体的密度ρ=![]() =
=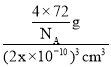 ,解得x=
,解得x=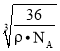 ×1010,故答案为:12;
×1010,故答案为:12;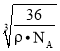 ×1010。
×1010。


科目:高中化学 来源: 题型:
【题目】科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,X比Y的原子系数小1,Z核外最外层电子数是X核外电子数的一半。下列叙述正确的是

A.Y原子能形成四核18电子的电中性分子
B.元素非金属性的顺序为X>Y>Z
C.W的单质与氧气反应不能产生含共价键的化合物
D.该新化合物中Y不满足最外层8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
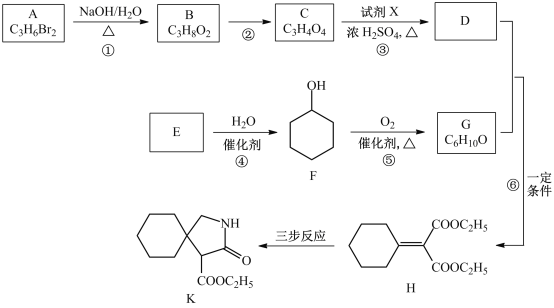
【题目】有机物K是某药物的前体,合成路线如图所示:
已知:R-CN![]()
![]() ;
;
![]()
![]() +
+![]()
(1)A的名称是_____________。
(2)反应①的化学方程式是___________________。
(3)反应②的类型是__________________。
(4)反应③中的试剂X是________________。
(5)E属于烃,其结构简式是_________________。
(6)H中所含的官能团是_________________。
(7)反应⑥的化学方程式是_____________________。
(8)H经三步反应合成K,写出中间产物I和J的结构简式______________。
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. PCl3的空间构型为平面三角形
B. HF、HCl、HBr、HI的熔沸点依次升高
C. 乳酸(![]() )有一对手性异构体,因为其分子中含有一个手性碳原子
)有一对手性异构体,因为其分子中含有一个手性碳原子
D. 氯的各种含氧酸的酸性由强到弱排列为HClO>HClO2>HClO3>HClO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对有机物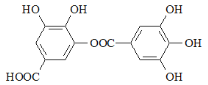 的叙述中,不正确的是
的叙述中,不正确的是
A. 常温下,该物质难溶于水
B. 1mol该有机物与NaOH溶液反应时,可消耗8mol NaOH
C. 酸性条件下水解,生成两种具有酸性的有机物
D. 遇FeCl3溶液显紫色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国明崇祯年间《徐光启手迹》记载了《造强水法》 :“绿钒(FeSO47H2O)五斤,硝五斤,将矾炒去,约折五分之一,将二味同研细,次用铁作锅,…… 锅下起火,取气冷定,开坛则药化为水……。用水入五金皆成水,惟黄金不化水中,加盐则化。……强水用过无力……”。下列有关解释错误的是
A.“将矾炒去,约折五分之一”后生成FeSO44H2O
B.该方法所造“强水”为硝酸
C.“惟黄金不化水中,加盐则化”的原因是加人 NaCl溶液后氧化性增强
D.“强水用过无力”的原因是“强水”用过以后,生成了硝酸盐溶液,其氧化性减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】激素类药物己烯雌酚的结构简式如图所示。下列叙述正确的是
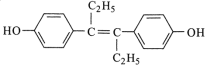
A.己烯雌酚是芳香烃
B.1mol己烯雌酚可与6molH2发生加成反应
C.1mol己烯雌酚完全燃烧能生成18molCO2和12 molH2O
D.己烯雌酚苯环上的一氯代物有两种(不包括立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某碱性电池的总反应为:3HO2-+2Al=OH-+2AlO2-+H2O,工作原理如图所示。下列叙述错误的是
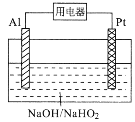
A.电子迁移方向:Al→用电器→Pt
B.电池工作时,负极附近溶液pH减小
C.正极反应式为:HO2-+3H+ +2e-=2H2O
D.负极会发生副反应:2Al+2OH-+2H2O=2AlO2-+3H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数的值,下列有关叙述中正确的是( )
A.在NA个P4分子中含有4NA个共价键
B.在含NA个硅原子的二氧化硅晶体中含有4NA个Si—O键
C.1mol Na2O2中,含有的阴离子数为2NA
D.向FeI2溶液中通入适量Cl2,当有1mol Fe2+被氧化时,转移的电子总数为3NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com