
【题目】激素类药物己烯雌酚的结构简式如图所示。下列叙述正确的是
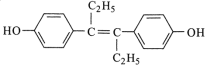
A.己烯雌酚是芳香烃
B.1mol己烯雌酚可与6molH2发生加成反应
C.1mol己烯雌酚完全燃烧能生成18molCO2和12 molH2O
D.己烯雌酚苯环上的一氯代物有两种(不包括立体异构)
 新编小学单元自测题系列答案
新编小学单元自测题系列答案科目:高中化学 来源: 题型:
【题目】已知:① X、Y、Z、W、R、Q为原子序数依次增大的短周期元素。X 是所有元素中原子半径最小的元素,Y是形成化合物种类最多的元素,W的最外层电子数是次外层电子数的3倍,Q与W同主族,Y、R原子的最外层电子数之和等于Z的最外层电子数。
②莱纳斯·卡尔·鲍林在1932年提出electronegativity作为元素原子在化合物某种性质的标度,electronegativity的大小可以判断元素金属性与非金属性强弱,下表列出部分短周期元素的Electronegativity的值。
元素 | X | Y | Z | W | R | Q |
electronegativity | 2.1 | 2.5 | 3.0 | 3.5 | 0.9 | 2.5 |
元素 | Mg | Li | Al | Cl | P | Be |
electronegativity | 1.2 | 1.0 | 1.5 | 3.0 | 2.1 | 1.5 |
请回答下列问题(涉及X、Y、Z、W、R、Q时,用元素符号表示):
(1)根据上表给出的数据,可知元素的electronegativity越大,__(填“金属性”或“非金属性”)越强。
(2)元素Q在周期表中的位置为_________。
(3)W、R、Q单核简单离子半径由大到小排列顺序为______。
(4)元素X、Z、W之间能形成多种10电子微粒,请写出反应物和产物均为X、Z、W之间形成的10电子微粒的一个离子方程式______________。
(5)一种由元素W、R组成的白色固体化合物,其电子式为_______________。
(6)试比较稳定性:X2W_____ X2Q;沸点:X2W_____ X2Q (填“<”或“>”)。
(7)元素 X、Y、Z、W、R、Q中的两种元素可形成原子个数比为1∶2的共价化合物,则这两种元素的原子序数之差不可能是_________。
A.2 B.4 C.5 D.7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面有关晶体的叙述中,不正确的是( )
A. 60gSiO2晶体中含Si-O键的个数为4NA(NA为阿伏加德罗常数)
B. 在立方ZnS晶体(如图所示)中,Zn2+、S2-的配位数都是8
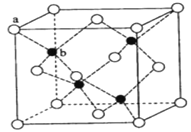
C. 设NaCl的摩尔质量为Mg·mol-1,NaCl的密度为ρg·cm-3,阿伏加德罗常数为NAmol-1,在NaCl晶体中,两个距离最近的Cl-中心间的距离为![]() cm
cm
D. CaO晶体结构与NaCl晶体结构相似,CaO晶体中Ca2+的配位数为6,且这些最邻近的O2-围成正八面体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁被誉为“第一金属”,铁及其化合物在生活中有广泛应用
(1)基态Fe3+的电子排布式为________。
(2)实验室用KSCN溶液、苯酚(![]() )检验Fe3+。N、O、S的第一电离能由大到小的顺序为_______(用元素符号表示),苯酚中碳原子的杂化轨道类型为______。
)检验Fe3+。N、O、S的第一电离能由大到小的顺序为_______(用元素符号表示),苯酚中碳原子的杂化轨道类型为______。
(3)FeCl3的熔点为306℃,沸点为315℃ FeCl3的晶体类型是______。FeSO4常作补铁剂,SO42-的立体构型是_______。
(4)基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等,1 mol Fe(CO)5分子中含σ键数目为_______,与CO互为等电子体的离子是__________(填化学式,写一种)
(5)氮化铁晶体的晶体结构示意图如图1所示。该晶体中铁、氮的微粒个数之比为______。
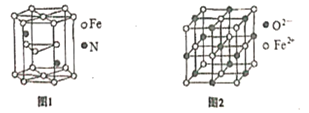
(6)氧化亚铁晶体的晶胞如图2所示。已知:氧化亚铁晶体的密度为ρg·cm-1,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为_____;Fe2+与O2-的最短间距为_______ pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究,其结构简式如图。下列关于分枝酸的叙述正确的是

A. 分子中含有3种官能团
B. 分枝酸的分子式为C10H10O6
C. 1mol分枝酸最多可与3molNaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是重要的金属材料,铝土矿(主要成分是Al2O3和少量的SiO2、Fe2O3杂质)是工业上制取铝的原料。实验室模拟工业上以铝土矿为原料制铵明矾晶体的工艺流程如图所示:
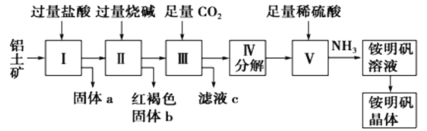
请回答下列问题:
(1)固体a的化学式为___,固体b化学式为___,Ⅲ中通入足量CO2气体发生反应的离子方程式为___。
(2)由Ⅴ制取铵明矾溶液的化学方程式为___。
(3)由I→II→III→IV都要用到的分离方法是___,由铵明矾溶液中制铵明矾晶体的操作是___,___,过滤,洗涤,干燥保存。
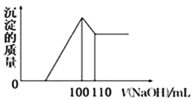
(4)向10gFe2O3、SiO2和Al2O3的混合物中,加入100mL稀硫酸,过滤后,向滤液中加入10mol/LNaOH溶液,产生沉淀的质量和加入NaOH溶液体积的关系曲线如图所示。则混合物中三氧化二铝的质量分数为___。
(5)有一种含铁、硅等元素的矿石,其主要成分的化学式为Na2Fe5(OH)2Si8O22,该物质中+2价铁与+3价铁的物质的量之比为___。将mg该矿石用足量的酸溶解后,加入过量铜粉使溶液中的铁元素全部变为Fe2+,过滤后滤液用cmol/L的KMnO4酸性溶液与Fe2+反应,用去VmL溶液。该矿石中铁元素的质量分数为___(用含m、c、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】麻黄素M是拟交感神经药。合成M的一种路线如图所示:
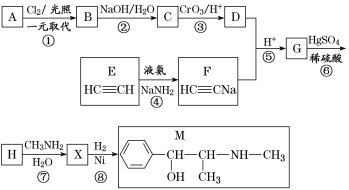
已知:Ⅰ.芳香烃A的相对分子质量为92
Ⅱ.R—CH2OH![]() RCHO
RCHO
III、R1-CHO+
IV、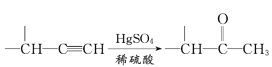
V、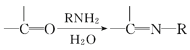
请回答下列问题:
(1)D的名称是_______;G中含氧官能团的名称是_______。
(2)反应②的反应类型为_______;A的结构简式为_______。
(3)写出反应⑦的化学方程式:______________________________。
(4)X分子中最多有_______个碳原子共平面。
(5)在H的同分异构体中,同时能发生水解反应和银镜反应的芳香族化合物中,核磁共振氢谱上有4组峰,且峰面积之比为1∶1∶2∶6的有机物的结构简式为_________________。
(6)已知:![]() 仿照上述流程,设计以苯、乙醛为主要原料合成某药物中间体
仿照上述流程,设计以苯、乙醛为主要原料合成某药物中间体![]() 的路线________________。
的路线________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如右图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是( )

A. 上下移动①中铜丝可控制SO2的量
B. ②中选用品红溶液验证SO2的生成
C. ③中选用NaOH溶液吸收多余的SO2
D. 为确认CuSO4生成,向①中加水,观察颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某课外活动小组用如图装置进行实验,试回答下列问题:
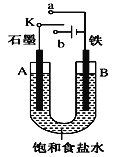
①若开始时开关K与a连接,则A极的电极反应式为____B极的Fe发生_____腐蚀(填“析氢”或“吸氧”)
②若开始时开关K与b连接,则装置内总反应的离子方程式为______;根据此时的装置,判断下列说法正确的是_____(填序号)
a. 溶液中Na+向A极移动
b. 从A极处逸出的气体能使湿润的KI淀粉试纸变蓝
c. 反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
d. 若标准状况下B极产生2.24L气体,则溶液中转移0.2mol电子
(2)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料。如LiFePO4电池中某电极的工作原理如下图所示:
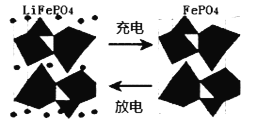
①已知该电池的电解质为能传导Li+的固体材料。放电时该电极是电池的_____极(填“正”或“负”),该电极反应式为_____。
②用此电池电解含有0.1mol/LCuSO4和0.1mol/LNaCl的混合溶液100mL,假如电路中转移了0.02mole-,且电解池的电极均为惰性电极,则阳极产生的气体在标准状况下的体积是_____L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com