
����Ŀ��������Ҫ�Ľ������ϣ���������Ҫ�ɷ���Al2O3��������SiO2��Fe2O3���ʣ��ǹ�ҵ����ȡ����ԭ�ϡ�ʵ����ģ�ҵ����������Ϊԭ�������������Ĺ���������ͼ��ʾ��
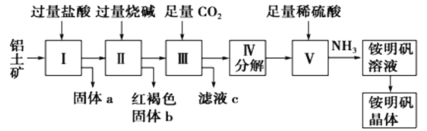
��ش��������⣺
��1������a�Ļ�ѧʽΪ___������b��ѧʽΪ___������ͨ������CO2���巢����Ӧ�����ӷ���ʽΪ___��
��2���ɢ���ȡ�������Һ�Ļ�ѧ����ʽΪ___��
��3����I��II��III��IV��Ҫ�õ��ķ��뷽����___�����������Һ�������������IJ�����___��___�����ˣ�ϴ�ӣ����ﱣ�档
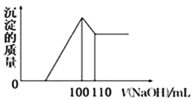
��4����10gFe2O3��SiO2��Al2O3�Ļ�����У�����100mLϡ���ᣬ���˺�����Һ�м���10mol/LNaOH��Һ�����������������ͼ���NaOH��Һ����Ĺ�ϵ������ͼ��ʾ������������������������������Ϊ___��
��5����һ�ֺ��������Ԫ�صĿ�ʯ������Ҫ�ɷֵĻ�ѧʽΪNa2Fe5(OH)2Si8O22����������+2������+3���������ʵ���֮��Ϊ___����mg�ÿ�ʯ�����������ܽ�������ͭ��ʹ��Һ�е���Ԫ��ȫ����ΪFe2+�����˺���Һ��cmol/L��KMnO4������Һ��Fe2+��Ӧ����ȥVmL��Һ���ÿ�ʯ����Ԫ�ص���������Ϊ___���ú�m��c��V�Ĵ���ʽ��ʾ����
���𰸡�SiO2 Fe(OH)3 AlO2-+CO2+2H2O��HCO3-+Al��OH��3�� Al2O3+4H2SO4+2NH3��2NH4Al��SO4��2+3H2O ���� ����Ũ�� ��ȴ�ᾧ 51% 3��2 ![]() ��100%
��100%
��������
���������Ҫ�ɷ��м���������������������ܽ⣬�������費�������ᣬ���ˣ���Һ�мӹ����ռ���Ȼ���ת������������������Ȼ���ת���ƫ�����ƣ����ˣ���ƫ��������Һ��ͨ�����Ķ�����̼�����������������ֽ�õ��������������������ܽ������������ͨ�����õ��������Һ���ᾧ�õ����壬�ݴ˹��̷������
(1)����������Ҫ�ɷ���Al2O3��Fe2O3�������������γ��Σ���SiO2�������ᷴӦ����˹���aΪSiO2�����Ȼ������Ȼ�������Һ�м�����������������Һ���Ȼ�����Ӧ���������������ɫ����������b���Ȼ������������Ʒ�Ӧ����ת���ƫ�����ƣ�ƫ�������������̼��Ӧ��������������������ӦΪ��AlO2-+CO2+2H2O��HCO3-+Al��OH��3����
�ʴ�Ϊ: SiO2��Fe(OH)3��AlO2-+CO2+2H2O��HCO3-+Al��OH��3����
��2��V�����������������������ͨ������Ӧ����������Ĺ��̣���ӦΪ��Al2O3+4H2SO4+2NH3��2NH4Al��SO4��2+3H2O��
�ʴ�Ϊ��Al2O3+4H2SO4+2NH3��2NH4Al��SO4��2+3H2O��
��3�����������̷�����֪I��II��III��IV���漰�����ܹ������Һ�ķ��룬Ӧ���ù��˵ķ������������Һ�������������Ӧ�ò��ý��½ᾧ�ķ������ȶ�ϡ��Һ��������Ũ�����ٽ��н��½ᾧ��Ȼ����˺�ϴ�ӣ����
�ʴ�Ϊ�����ˣ�����Ũ������ȴ�ᾧ��
��4�������������ж������費�������ᣬ������������ת����Ȼ������Ȼ������ټӼ���ʼ��û�г�������˵����������������������к�δ��Ӧ���ᣬ�����η�Ӧ����������ֱ�������������ֵ���ټӼ��������������������ƣ���������������Ӧ�����ͼʾ��֪100-110mL�η������·�Ӧ��![]() �������������Ƶ����ʵ���Ϊ��
�������������Ƶ����ʵ���Ϊ��![]() �����������������ʵ���ҲΪ0.1mol��������Ԫ���غ��֪�������������ʵ���Ϊ0.05mol������������������������������Ϊ=
�����������������ʵ���ҲΪ0.1mol��������Ԫ���غ��֪�������������ʵ���Ϊ0.05mol������������������������������Ϊ=![]() ��
��
�ʴ�Ϊ��51%��
��5����ѧʽNa2Fe5(OH)2Si8O22����1mol��������+2����Ϊxmol��+3����ymol����x+y=5���ٽ�ϻ��������������ϼ۵Ĵ�����Ϊ��ɵã�![]() �������ã�2x+3y=12����ã�x=3��y=2��+2������+3���������ʵ���֮��Ϊ3:2��KMnO4������Һ��Fe2+��Ӧ��
�������ã�2x+3y=12����ã�x=3��y=2��+2������+3���������ʵ���֮��Ϊ3:2��KMnO4������Һ��Fe2+��Ӧ��![]() ����Ӧ���ĵĸ�����ص����ʵ���Ϊ��
����Ӧ���ĵĸ�����ص����ʵ���Ϊ��![]() ����n��Fe2+��=
����n��Fe2+��=![]() ���ÿ�ʯ����Ԫ�ص���������=
���ÿ�ʯ����Ԫ�ص���������=![]() =
=![]() ��100%��
��100%��
�ʴ�Ϊ��3:2��![]() ��100%��
��100%��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ���м�������
����������ͬ����һ������ͬһ��Ԫ��
��ͬһԪ�صĺ�������������������
��18gH2O�к��е�������Ϊ10NA
�ܱ�״���£������CH4��HF�����ķ�������ͬ
��ͨ����ѧ�仯����ʵ��![]() ��
��![]() ֮����ת��
֮����ת��
A.2��B.3��C.4��D.5��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����( )
A. PCl3�Ŀռ乹��Ϊƽ��������
B. HF��HCl��HBr��HI���۷е���������
C. ����(![]() )��һ�������칹��,��Ϊ������к���һ������̼ԭ��
)��һ�������칹��,��Ϊ������к���һ������̼ԭ��
D. �ȵĸ��ֺ������������ǿ��������ΪHClO>HClO2>HClO3>HClO4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ���������䡶������ּ��������ˡ���ǿˮ���� �����̷�(FeSO47H2O)������������ȥ��Լ�����֮һ������ζͬ��ϸ������������������ �������ȡ���䶨����̳��ҩ��Ϊˮ��������ˮ�����Գ�ˮ��Ω�ƽ�ˮ�У�����������ǿˮ�ù������������������йؽ��ʹ������
A.��������ȥ��Լ�����֮һ��������FeSO44H2O
B.�÷������조ǿˮ��Ϊ����
C.��Ω�ƽ�ˮ�У���������ԭ���Ǽ��� NaCl��Һ����������ǿ
D.��ǿˮ�ù���������ԭ���ǡ�ǿˮ���ù��Ժ���������������Һ���������Լ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ҩ�Zϩ�ƷӵĽṹ��ʽ��ͼ��ʾ������������ȷ����
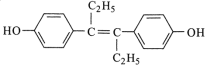
A.��ϩ�Ʒ��Ƿ�����
B.1mol��ϩ�Ʒӿ���6molH2�����ӳɷ�Ӧ
C.1mol��ϩ�Ʒ���ȫȼ��������18molCO2��12 molH2O
D.��ϩ�Ʒӱ����ϵ�һ�ȴ���������(�����������칹)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ӿ���Ч��ͻ����������ǣ�������ȡ����ͭ���˲��õķ����ǣ� ��
A.Cu+HNO3��Ũ����Cu(NO3)2
B.Cu+HNO3��ϡ����Cu(NO3)2
C.Cu![]() CuO
CuO![]() Cu(NO3)2
Cu(NO3)2
D.Cu+AgNO3��Cu(NO3)2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���Ե�ص��ܷ�ӦΪ��3HO2-��2Al=OH-��2AlO2-��H2O������ԭ����ͼ��ʾ�����������������
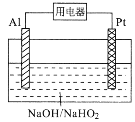
A.����Ǩ�Ʒ���Al���õ�����Pt
B.��ع���ʱ������������ҺpH��С
C.������ӦʽΪ��HO2-��3H+ +2e��=2H2O
D.�����ᷢ������Ӧ��2Al+2OH����2H2O=2AlO2-��3H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������ʣ��� N2����Na2O2����NaOH����HCl����H2O2����MgF2����NH4Cl��
(1)ֻ�ɷǼ��Լ����ɵ�������__________________(����)��
(2)�����Ӽ��ͼ��Լ����ɵ�������_______________��
(3)��H2O2�ĵ���ʽΪ��_________________��
(4)�õ���ʽ��ʾ��MgF2���γɹ��̣�______________��
(5)����˵������ȷ����________��
�ٹ��ۻ������к����ۼ���Ҳ���ܺ����Ӽ�
����ΪH2CO3���ԣ�H2SO3���ԣ����Էǽ�����C��S
�ۺ�����Ԫ�صĻ����ﲻһ�������ӻ�����
���ɷǽ���Ԫ����ɵĻ�����һ���ǹ��ۻ�����
������״̬�ܵ�������������ӻ�����
���ɷ�����ɵĻ�������һ�����ڹ��ۼ�
A. �٢ۢ� B. �٢ڢ� C. �٢ڢܢ� D. �٢ۢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ҵ������и���ѧ����ͼ��ʾ�����й����Ҵ��ڲ�ͬ�ķ�Ӧ�ж��ѻ�ѧ����˵���������

A. ������Ʒ�Ӧʱ�����ٶ���
B. �ڼ��Ⱥ�Cu������O2��Ӧʱ�����١��۶���
C. ��Ũ���Ṳ�ȷ�����ȥ��Ӧʱ�����ڢ۶���
D. �����ᡢŨ���Ṳ�ȷ���������Ӧʱ�����ٶ���
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com