
【题目】科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,X比Y的原子系数小1,Z核外最外层电子数是X核外电子数的一半。下列叙述正确的是

A.Y原子能形成四核18电子的电中性分子
B.元素非金属性的顺序为X>Y>Z
C.W的单质与氧气反应不能产生含共价键的化合物
D.该新化合物中Y不满足最外层8电子稳定结构
【答案】A
【解析】
该化合物由阴、阳离子构成,说明它是离子化合物。从该化合物的结构式看出,W为金属元素;1个Z原子形成1个共价键,说明Z原子最外层有1个或7个电子;1个X原子形成4个共价键,说明X原子最外层有4个电子;Y原子形成2个共价键,阴离子得1个电子,说明Y原子最外层有5个电子;Z核外最外层电子数是X核外电子数的一半,则Z为Cl,X为Si元素;W、X、Y、Z为同一短周期元素,则W为Na,Y为P,据此解答。
根据分析可知,W、X、Y、Z分别为Na、Si、P、Cl元素。
A.Y为P,PH3为四核18电子的电中性分子,故A正确;
B.X、Y、Z分别为Si、P、Cl,同周期从左到右,元素的非金属性逐渐增强,故非金属性X<Y<Z,故B错误;
C.W为Na,Na和氧气在点燃条件下生成Na2O2,含有共价键,故C错误;
D.2个硅原子和1个P原子形成2个共价键,阴离子得到1个电子,所以该化合物中磷原子最外层达到8电子稳定结构,故D错误。
答案选A。


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
【题目】臭氧是理想的烟气脱硝剂,其脱硝反应为 2NO2(g)+O3(g) ![]() N2O5(g)+O2(g)。有关说法正确的是( )
N2O5(g)+O2(g)。有关说法正确的是( )
A. 增大压强可增大反应速率 B. 升高温度可减小反应速率
C. 达到平衡时,v(正)=v(逆)=0 D. 达到平衡时,NO2转化率为100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的资源宝库,从海水中提取食盐和溴的过程如图所示;下列描述错误的是:

A. 淡化海水的方法主要有蒸馏法、电渗析法、离子交换法
B. 以NaCl为原料可以生产烧碱、纯碱、金属钠、氯气、盐酸等化工产品
C. 步骤Ⅱ中鼓入热空气吹出溴,是因为溴蒸气的密度比空气的密度小
D. 用SO2水溶液吸收Br2的离子反应方程式为:Br2+SO2+2H2O═4H++SO42﹣+2Br﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种烃的衍生物A和B,所含碳、氢、氧的质量比均为6∶1∶4。完全燃烧0.1 mol A能生成3.6 g水。B只含一个醛基,1.1g B与足量银氨溶液反应,可析出2.7 g Ag。则下列关于物质A和物质B的判断正确的是
A. 物质A一定是乙醛
B. 物质A和物质B互为同分异构体
C. 物质B的同分异构体中既含有醛基又含有羟基的有6种
D. 物质B属于酯类的同分异构体有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从石油中裂解获得A是目前工业上生产A的主要途径,图中的N是高分子化合物。以A和1,3-丁二烯为原料合成N的流程如图所示。
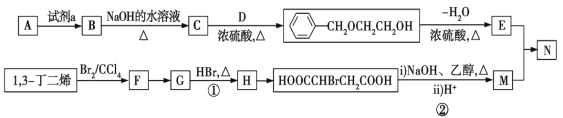
请回答下列问题:
(1)D物质的名称为________;B→C的化学方程式为_______________________。
(2)G中官能团的名称为_____________,C→E涉及的反应类型为________________。
(3)在催化剂存在下,E和M等物质的量发生聚合反应,N的结构简式为______________。
(4)E有多种同分异构体,符合下列条件的同分异构体最多有_____种(不考虑立体异构)。
①可与Na2CO3溶液反应;②分子中只有一个环状结构。
其中核磁共振氢谱中峰数最少的有机物的结构简式为____________________。
(5)试以异戊二烯CH2=C(CH3)CH=CH2为原料(其他无机试剂任选),设计制备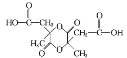 的合成路线,写出合成路线流程图(合成路线流程图可仿照题干)____________________。
的合成路线,写出合成路线流程图(合成路线流程图可仿照题干)____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中,由CO合成甲醇:CO(g)+2H2(g)![]() CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是
CH3OH(g),在其他条件不变的情况下,研究温度对反应的影响,实验结果如图所示,下列说法正确的是

A.CO合成甲醇的反应为吸热反应B.平衡常数![]()
C.该反应在![]() 时的平衡常数比
时的平衡常数比![]() 时的小D.处于A点的反应体系从
时的小D.处于A点的反应体系从![]() 变到
变到![]() ,达到平衡时
,达到平衡时![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:① X、Y、Z、W、R、Q为原子序数依次增大的短周期元素。X 是所有元素中原子半径最小的元素,Y是形成化合物种类最多的元素,W的最外层电子数是次外层电子数的3倍,Q与W同主族,Y、R原子的最外层电子数之和等于Z的最外层电子数。
②莱纳斯·卡尔·鲍林在1932年提出electronegativity作为元素原子在化合物某种性质的标度,electronegativity的大小可以判断元素金属性与非金属性强弱,下表列出部分短周期元素的Electronegativity的值。
元素 | X | Y | Z | W | R | Q |
electronegativity | 2.1 | 2.5 | 3.0 | 3.5 | 0.9 | 2.5 |
元素 | Mg | Li | Al | Cl | P | Be |
electronegativity | 1.2 | 1.0 | 1.5 | 3.0 | 2.1 | 1.5 |
请回答下列问题(涉及X、Y、Z、W、R、Q时,用元素符号表示):
(1)根据上表给出的数据,可知元素的electronegativity越大,__(填“金属性”或“非金属性”)越强。
(2)元素Q在周期表中的位置为_________。
(3)W、R、Q单核简单离子半径由大到小排列顺序为______。
(4)元素X、Z、W之间能形成多种10电子微粒,请写出反应物和产物均为X、Z、W之间形成的10电子微粒的一个离子方程式______________。
(5)一种由元素W、R组成的白色固体化合物,其电子式为_______________。
(6)试比较稳定性:X2W_____ X2Q;沸点:X2W_____ X2Q (填“<”或“>”)。
(7)元素 X、Y、Z、W、R、Q中的两种元素可形成原子个数比为1∶2的共价化合物,则这两种元素的原子序数之差不可能是_________。
A.2 B.4 C.5 D.7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D、E的原子序数依次增大,已知:
①C的最高价氧化物对应的水化物与其气态氢化物反应可生成盐;
②A的氧化物是生活中最常见液体,A、E同主族,C与B、D相邻;
③A、B、C、D四种元素组成一种离子化合物F,其组成原子数之比为5︰1︰1︰3。
请回答下列问题:
(1)C的气态氢化物的电子式为___,A在周期表中的位置___。
(2)化合物E2D2中阴、阳离子个数比为___,F含有的化学键类型为___。
(3)F溶液与足量EDA的稀溶液混合,其离子方程式为___。
(4)氯气与C的气态氢化物相遇有白烟及C2生成,写出其化学反应方程式___。
(5)C2A4空气燃料电池是一种环境友好的碱性燃料电池,电解质溶液是20%~30%KOH溶液。该燃料电池的负极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁被誉为“第一金属”,铁及其化合物在生活中有广泛应用
(1)基态Fe3+的电子排布式为________。
(2)实验室用KSCN溶液、苯酚(![]() )检验Fe3+。N、O、S的第一电离能由大到小的顺序为_______(用元素符号表示),苯酚中碳原子的杂化轨道类型为______。
)检验Fe3+。N、O、S的第一电离能由大到小的顺序为_______(用元素符号表示),苯酚中碳原子的杂化轨道类型为______。
(3)FeCl3的熔点为306℃,沸点为315℃ FeCl3的晶体类型是______。FeSO4常作补铁剂,SO42-的立体构型是_______。
(4)基铁[Fe(CO)5]可用作催化剂、汽油抗爆剂等,1 mol Fe(CO)5分子中含σ键数目为_______,与CO互为等电子体的离子是__________(填化学式,写一种)
(5)氮化铁晶体的晶体结构示意图如图1所示。该晶体中铁、氮的微粒个数之比为______。
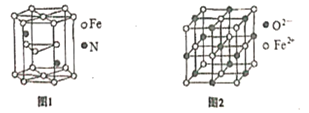
(6)氧化亚铁晶体的晶胞如图2所示。已知:氧化亚铁晶体的密度为ρg·cm-1,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为_____;Fe2+与O2-的最短间距为_______ pm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com