
【题目】一定温度下,在![]() 的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )
的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列描述正确的是( )
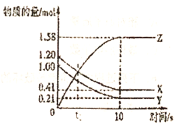
A.![]() 后,该反应停止进行
后,该反应停止进行
B.反应的化学方程式为:![]()
C.在t1时刻,正反应速率等于逆反应速率
D.反应前![]() 内,以Z表示的平均反应速率为
内,以Z表示的平均反应速率为![]()
【答案】D
【解析】
A.由图可知,l0s后,该反应到达平衡状态,化学平衡状态是动态平衡,v(正)=v(逆)≠0,故A错误;
B.由图象可以看出,由图表可知,随反应进行X、Y的物质的量减小,Z的物质的量增大,所以X、Y是反应物,Z是生产物,l0s后X、Y、Z的物质的量为定值,不为0,反应是可逆反应,且△n(X):△n(Y):△n(Z)=(1.20-0.41)mol:(1.00-0.21)mol:1.58mol=1:1:2,参加反应的物质的物质的量之比等于化学计量数之比,故反应化学方程式为X(g)+Y(g)![]() 2Z(g),故B错误;
2Z(g),故B错误;
C.在t1时刻之后,X、Y的物质的量减小,Z的物质的量增大,反应向正反应进行,t1时刻正反应速率大于逆反应速率,故C错误;
D.10s内,用Z表示的反应速率为v(Z)=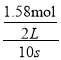 = 0.079moL/(Ls),故D正确;
= 0.079moL/(Ls),故D正确;
故答案为D。


 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:
【题目】用如右图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是( )

A. 上下移动①中铜丝可控制SO2的量
B. ②中选用品红溶液验证SO2的生成
C. ③中选用NaOH溶液吸收多余的SO2
D. 为确认CuSO4生成,向①中加水,观察颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某课外活动小组用如图装置进行实验,试回答下列问题:
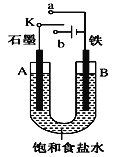
①若开始时开关K与a连接,则A极的电极反应式为____B极的Fe发生_____腐蚀(填“析氢”或“吸氧”)
②若开始时开关K与b连接,则装置内总反应的离子方程式为______;根据此时的装置,判断下列说法正确的是_____(填序号)
a. 溶液中Na+向A极移动
b. 从A极处逸出的气体能使湿润的KI淀粉试纸变蓝
c. 反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
d. 若标准状况下B极产生2.24L气体,则溶液中转移0.2mol电子
(2)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料。如LiFePO4电池中某电极的工作原理如下图所示:
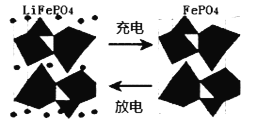
①已知该电池的电解质为能传导Li+的固体材料。放电时该电极是电池的_____极(填“正”或“负”),该电极反应式为_____。
②用此电池电解含有0.1mol/LCuSO4和0.1mol/LNaCl的混合溶液100mL,假如电路中转移了0.02mole-,且电解池的电极均为惰性电极,则阳极产生的气体在标准状况下的体积是_____L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)![]() 的名称是_______。
的名称是_______。
(2)分子式符合C7H16且含有四个甲基的结构有__________种。
(3)核磁共振仪处理![]() ,氢谱图中有___种氢,峰面积之比为____。
,氢谱图中有___种氢,峰面积之比为____。
(4)水的熔沸点比同主族其它氢化物的都高,原因是______。
(5)将有机物A置于氧气流中充分燃烧,实验测得:生成5.4gH2O和8.8gCO2,消耗氧气6.72L(标准状况下),则A的实验式是___,用质谱仪测定A的相对分子质量,得到如图所示质谱图,则其相对分子质量为____,A的分子式是____。
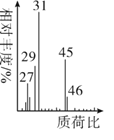
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为锌铜原电池示意图,下列说法错误的是( )
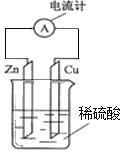
A.锌片为负极,且锌片逐渐溶解
B.电子由锌片通过导线流向铜片
C.铜为正极,铜不易失电子而受到保护
D.溶液中阳离子向![]() 极移动,且
极移动,且![]() 极上发生的是氧化反应
极上发生的是氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】普伐他汀是一种调节血脂的药物,其结构简式如图所示(未表示出其空间构型)。
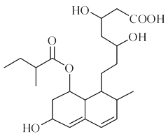
下列关于普伐他汀的性质描述正确的是 ( )
A. 能与FeCl3溶液发生显色反应
B. 该物质的分子式为C23H38O7
C. 能发生加成、取代、消去反应,能使酸性KMnO4溶液褪色
D. 1mol该物质最多可与1molNaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由硫铁矿“烧渣”(主要成分:Fe3O4、Fe2O3和FeO)制备绿矾(FeSO4·7H2O))的流程如图:

已知:FeS2(S的化合价为-1)难溶于水。
(1)①中加入的酸为___,滤渣2的主要成分是___。
(2)①中生成Fe3+的离子方程式为Fe3O4+8H+=2Fe3++Fe2++4H2O、___。
(3)检验②中Fe3+已经完全转化成Fe2+的实验方法:取适量溶液2,___。
(4)通过③得到绿矾晶体的实验操作:加热浓缩、冷却结晶、___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阅读短文,回答问题。
合成氨工业结束了人类依靠天然氮肥的历史,解决了人类的粮食问题。近一百年来,工业上一直采用在高温、高压、催化剂的条件下将氮气和氢气转化为氨气,这样的条件每年需要消耗全世界1%~2%的能源供应,科学家一直致力于探索在温和条件下合成氨。中科大研究团队研制了“钌单原子催化剂”合成氨,应用该催化剂通过电化学反应在室温下即可合成氨。原理如图1所示。
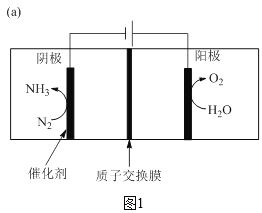
阴极表面电极反应的微观过程如图2所示。
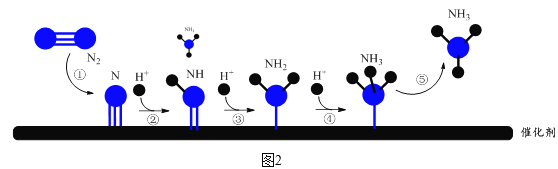
该项研究工作开辟了单原子催化剂在电化学合成氨反应中的新途径,使得温和条件下合成氨成为可能。
请依据以上短文,判断下列说法是否正确(填“对”或“错”)。
(1)合成氨工业对解决人类的粮食问题发挥了重要作用。___
(2)传统方法合成氨的化学方程式为N2+3H2![]() 2NH3。___
2NH3。___
(3)传统合成氨的方法需消耗大量能源。___
(4)“钌单原子催化剂”合成氨体现了我国科学家在科研领域的创新。___
(5)图1中,水在阳极失去电子生成氧气。___
(6)图2中,步骤②所示反应的方程式为有N+H+NH。___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据氧化还原反应:2Ag++Cu=Cu2++2Ag设计的原电池如图所示。请回答下列问题:

(1)电极X的材料是________;
(2)X电极发生的电极反应式为____________________;银电极上发生的电极反应为________(填“氧化”或“还原”)反应。
(3)外电路中的电子________(填“流出”或“流向”)Ag电极。
(4)当有3.2 g铜溶解时,银电极增重________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com